よむ、つかう、まなぶ。
資料1:臨床研究で得られた情報を薬事申請に利活用できる仕組み (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
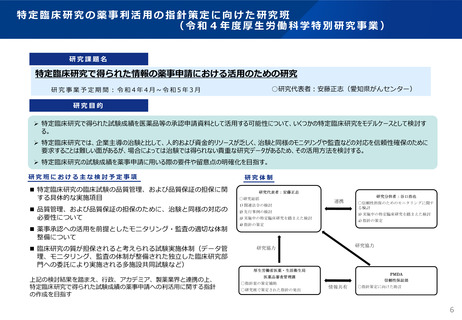
特定臨床研究を薬事申請に利活用する場合の留意点・考え方②
(令和4年3月31日付け事務連絡)
信頼性の水準
➢承認申請における当該臨床研究の位置付け等を総合的に考慮した上で求められる信頼性の水準が判断される。
➢研究責任医師は、当該臨床研究の適切な実施を担保するとともに、当該研究の信頼性担保の状況について説
明できることが必要。
➢申請者は研究責任医師との間で適合性調査に関する協力体制を構築していることが望ましい。
資料作成過程の適切性
• 研究責任医師が症例報告書からデータセットの作成、集計解析及び解析報告書の作成までの過程の適切性
を適切に説明できる。
• また、申請者が承認申請に利用するにあたり当該手順の適切性を確認できる
医薬品の品質確保
• 既承認医薬品を使用している場合は、研究責任医師が適切な保管等の管理を行い、適切な品質が保持され
ていることを適切に説明できる
(例えば、ロット番号や使用期限、保管条件の遵守状況など適切な記録)
副作用情報の収集
• 対象者保護の観点から副作用情報の収集状況及びその妥当性を研究責任医師が適切に説明できる
4
(令和4年3月31日付け事務連絡)
信頼性の水準
➢承認申請における当該臨床研究の位置付け等を総合的に考慮した上で求められる信頼性の水準が判断される。
➢研究責任医師は、当該臨床研究の適切な実施を担保するとともに、当該研究の信頼性担保の状況について説
明できることが必要。
➢申請者は研究責任医師との間で適合性調査に関する協力体制を構築していることが望ましい。
資料作成過程の適切性
• 研究責任医師が症例報告書からデータセットの作成、集計解析及び解析報告書の作成までの過程の適切性
を適切に説明できる。
• また、申請者が承認申請に利用するにあたり当該手順の適切性を確認できる
医薬品の品質確保
• 既承認医薬品を使用している場合は、研究責任医師が適切な保管等の管理を行い、適切な品質が保持され
ていることを適切に説明できる
(例えば、ロット番号や使用期限、保管条件の遵守状況など適切な記録)
副作用情報の収集
• 対象者保護の観点から副作用情報の収集状況及びその妥当性を研究責任医師が適切に説明できる
4