よむ、つかう、まなぶ。
資料1:臨床研究で得られた情報を薬事申請に利活用できる仕組み (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
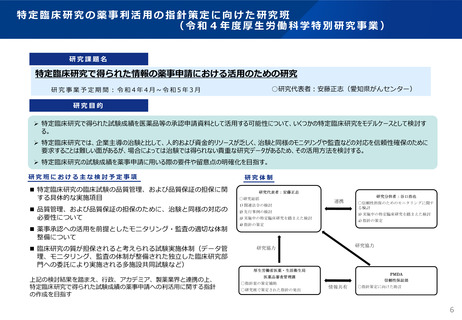
特定臨床研究の薬事利活用の指針策定に向けた研究班
(令和4年度厚生労働科学特別研究事業)
研究課題名
特定臨床研究で得られた情報の薬事申請における活用のための研究
○研究代表者:安藤正志(愛知県がんセンター)
研究事業予定期間:令和4年4月~令和5年3月
研究目的
➢ 特定臨床研究で得られた試験成績を医薬品等の承認申請資料として活用する可能性について、いくつかの特定臨床研究をモデルケースとして検討す
る。
➢ 特定臨床研究では、企業主導の治験と比して、人的および資金的リソースが乏しく、治験と同様のモニタリングや監査などの対応を信頼性確保のために
要求することは難しい面があるが、場合によっては治験では得られない貴重な研究データがあるため、その活用方法を検討する。
➢ 特定臨床研究の試験成績を薬事申請に用いる際の要件や留意点の明確化を目指す。
研究班における主な検討予定事項
研究体制
【研究体制】
◼ 特定臨床研究の臨床試験の品質管理、および品質保証の担保に関
する具体的な実施項目
連携
◼ 品質管理、および品質保証の担保のために、治験と同様の対応の
必要性について
◼ 薬事承認への活用を前提としたモニタリング・監査の適切な体制
整備について
◼ 臨床研究の質が担保されると考えられる試験実施体制(データ管
理、モニタリング、監査の体制が整備された独立した臨床研究部
門への委託により実施される多施設共同試験など)
上記の検討結果を踏まえ、行政、アカデミア、製薬業界と連携の上、
特定臨床研究で得られた試験成績の薬事申請への利活用に関する指針
の作成を目指す
研究協力
研究協力
情報共有
6
(令和4年度厚生労働科学特別研究事業)
研究課題名
特定臨床研究で得られた情報の薬事申請における活用のための研究
○研究代表者:安藤正志(愛知県がんセンター)
研究事業予定期間:令和4年4月~令和5年3月
研究目的
➢ 特定臨床研究で得られた試験成績を医薬品等の承認申請資料として活用する可能性について、いくつかの特定臨床研究をモデルケースとして検討す
る。
➢ 特定臨床研究では、企業主導の治験と比して、人的および資金的リソースが乏しく、治験と同様のモニタリングや監査などの対応を信頼性確保のために
要求することは難しい面があるが、場合によっては治験では得られない貴重な研究データがあるため、その活用方法を検討する。
➢ 特定臨床研究の試験成績を薬事申請に用いる際の要件や留意点の明確化を目指す。
研究班における主な検討予定事項
研究体制
【研究体制】
◼ 特定臨床研究の臨床試験の品質管理、および品質保証の担保に関
する具体的な実施項目
連携
◼ 品質管理、および品質保証の担保のために、治験と同様の対応の
必要性について
◼ 薬事承認への活用を前提としたモニタリング・監査の適切な体制
整備について
◼ 臨床研究の質が担保されると考えられる試験実施体制(データ管
理、モニタリング、監査の体制が整備された独立した臨床研究部
門への委託により実施される多施設共同試験など)
上記の検討結果を踏まえ、行政、アカデミア、製薬業界と連携の上、
特定臨床研究で得られた試験成績の薬事申請への利活用に関する指針
の作成を目指す
研究協力
研究協力
情報共有
6