よむ、つかう、まなぶ。
資料1:臨床研究で得られた情報を薬事申請に利活用できる仕組み (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
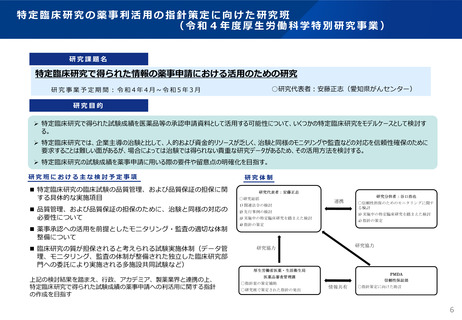
特定臨床研究で得られた情報の薬事申請における利活用について
検討の経過
⚫ 特定臨床研究で得られたデータを薬事申請に活用するには、治験と同程度の信頼
性が確保されていることを申請者が確認していることが前提。
⚫ そこで、一部変更申請を予定している個別品目をパイロット的に取り上げ、企業
と厚労省・PMDAにおいて、特定臨床研究で得られた既存データを活用して承認
申請を行う場合の信頼性確保等について協議を行った。
⚫ 具体的には、薬事申請への活用に向け、申請における試験の位置づけに応じた
データの信頼性が確保されているかどうかを確認すべく、まず以下を初めとした
基本的な事項を精査。
➢ 申請者が、試験の品質管理・品質保証プロセスを根拠資料に基づき確認・点
検できること
➢ 申請者が、詳細な解析データにアクセスし、申請資料を作成することができ
ること
など
⚫ これらの検討・精査から得られた知見等を基に、特定臨床研究で得られたデータ
を薬事申請に活用する場合の要件、留意点等を一例として取りまとめ、事務連絡
を発出。
2
検討の経過
⚫ 特定臨床研究で得られたデータを薬事申請に活用するには、治験と同程度の信頼
性が確保されていることを申請者が確認していることが前提。
⚫ そこで、一部変更申請を予定している個別品目をパイロット的に取り上げ、企業
と厚労省・PMDAにおいて、特定臨床研究で得られた既存データを活用して承認
申請を行う場合の信頼性確保等について協議を行った。
⚫ 具体的には、薬事申請への活用に向け、申請における試験の位置づけに応じた
データの信頼性が確保されているかどうかを確認すべく、まず以下を初めとした
基本的な事項を精査。
➢ 申請者が、試験の品質管理・品質保証プロセスを根拠資料に基づき確認・点
検できること
➢ 申請者が、詳細な解析データにアクセスし、申請資料を作成することができ
ること
など
⚫ これらの検討・精査から得られた知見等を基に、特定臨床研究で得られたデータ
を薬事申請に活用する場合の要件、留意点等を一例として取りまとめ、事務連絡
を発出。
2