よむ、つかう、まなぶ。
資料1:臨床研究で得られた情報を薬事申請に利活用できる仕組み (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
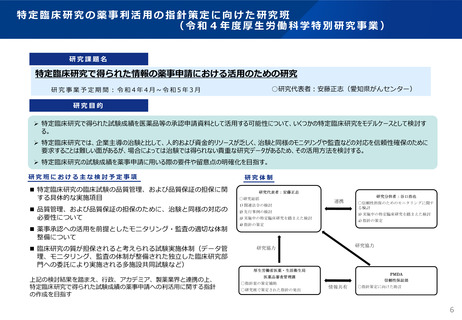
特定臨床研究を薬事申請に利活用する場合の留意点・考え方①
(令和4年3月31日付け事務連絡)
「特定臨床研究で得られた試験成績を医薬品の承認申請に利用する場合の
留意点・考え方の例示について」
(令和4年3月31日厚生労働省医薬・生活衛生局医薬品審査管理課事務連絡)
試験計画立案の段階で、得られる結果を薬事申請に利活用することを前提とする
場合は治験として行うことが原則であるものの、改めて治験を実施することが困難な
場合には、治験と同程度の信頼性の確保された臨床研究結果を薬事申請に利
活用できる仕組みが必要。
⇒求められる信頼性の水準を満たす臨床研究については、薬事申請に利活用す
ることができる。
●
● これを受け、特定臨床研究で得られた試験成績を利用し、実際に承認申請に
至った個別の申請事例をもとに留意点・考え方の一例を示した。
● 全ての申請事例に当てはまるものではなく、今後の検討や知見の集積等に応じ
て見直すことを予定
3
(令和4年3月31日付け事務連絡)
「特定臨床研究で得られた試験成績を医薬品の承認申請に利用する場合の
留意点・考え方の例示について」
(令和4年3月31日厚生労働省医薬・生活衛生局医薬品審査管理課事務連絡)
試験計画立案の段階で、得られる結果を薬事申請に利活用することを前提とする
場合は治験として行うことが原則であるものの、改めて治験を実施することが困難な
場合には、治験と同程度の信頼性の確保された臨床研究結果を薬事申請に利
活用できる仕組みが必要。
⇒求められる信頼性の水準を満たす臨床研究については、薬事申請に利活用す
ることができる。
●
● これを受け、特定臨床研究で得られた試験成績を利用し、実際に承認申請に
至った個別の申請事例をもとに留意点・考え方の一例を示した。
● 全ての申請事例に当てはまるものではなく、今後の検討や知見の集積等に応じ
て見直すことを予定
3