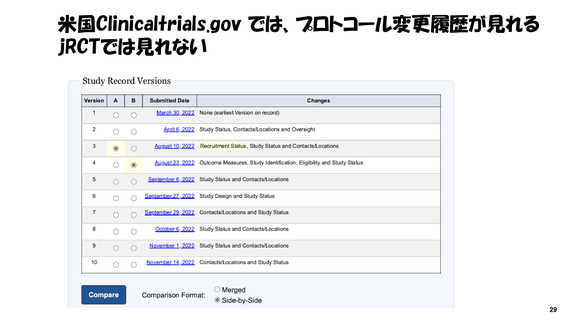
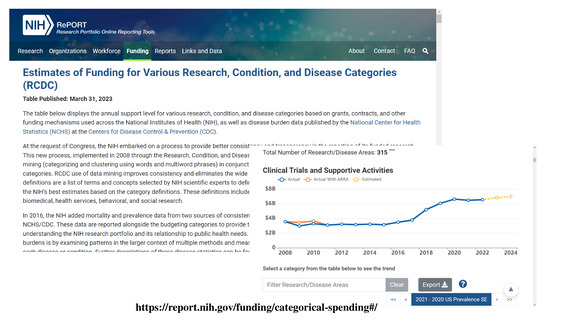
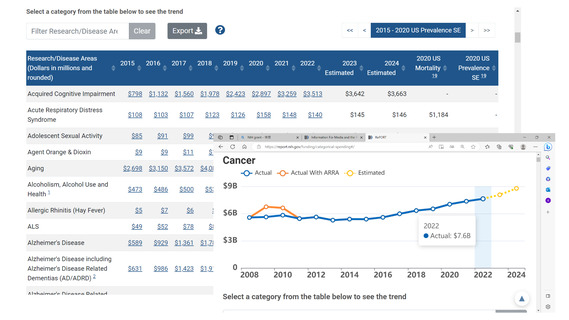
よむ、つかう、まなぶ。
資料2-7_藤原参考人提出資料 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33877.html |
| 出典情報 | 今後のがん研究のあり方に関する有識者会議(第12回 6/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
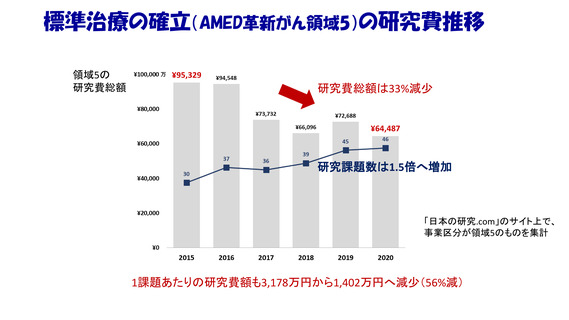
分析のまとめ
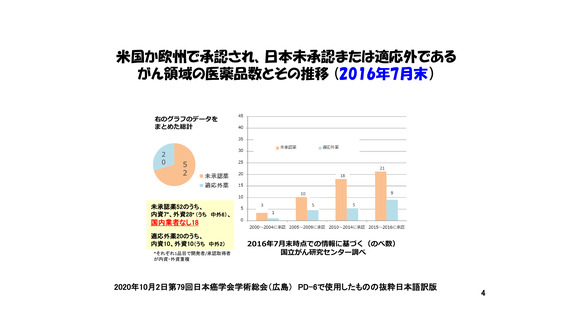
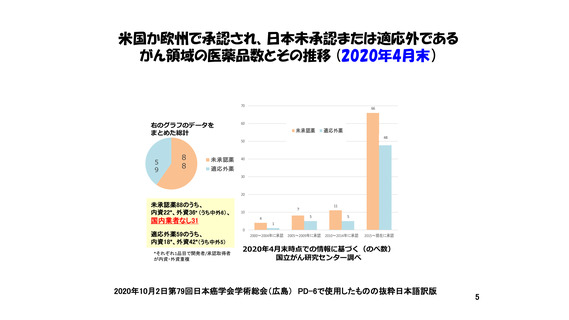
・PMDAの審査に要する期間は世界最速レベルを維持しているが
抗がん剤のドラッグ・ラグは拡大。
要因のひとつに、
日本法人や国内管理人を持たない企業
(Emerging Biopharma; EBP)が
多くの抗がん剤開発を担っているため、
わが国での開発を行ってくれていない実態がある。
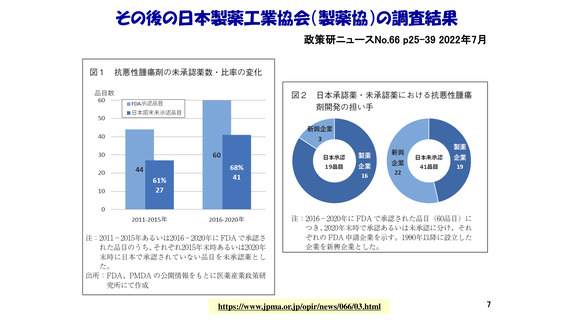
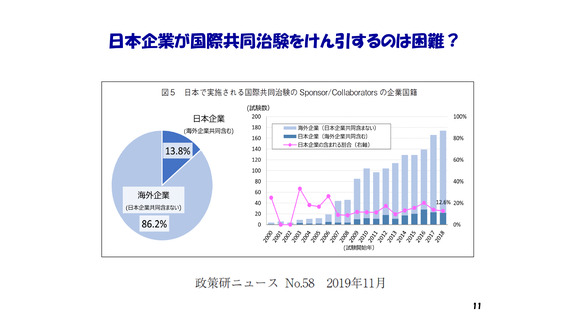
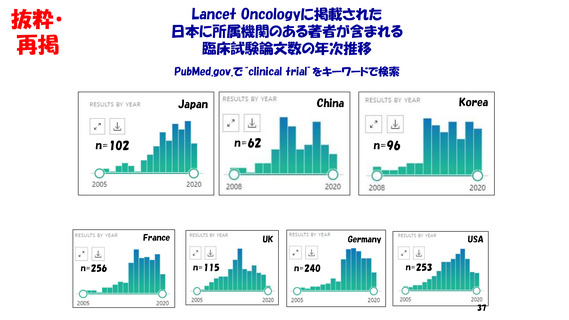
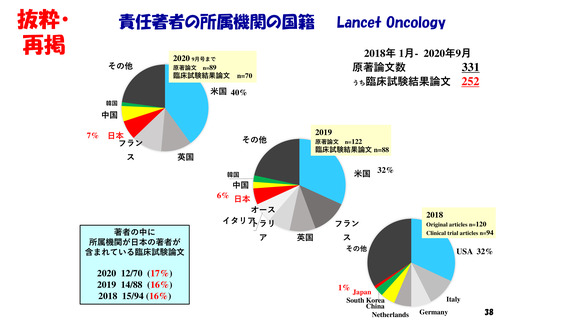
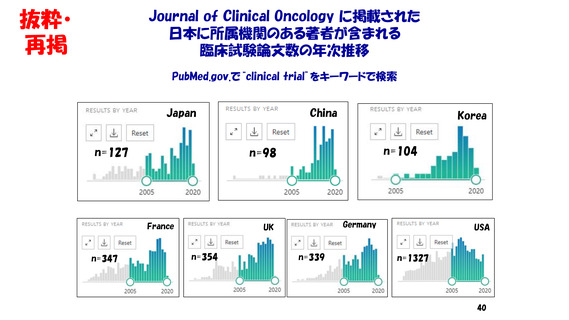
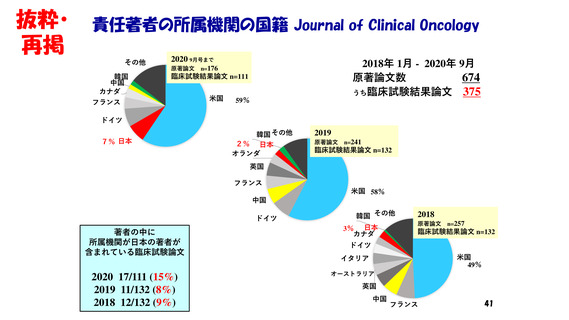
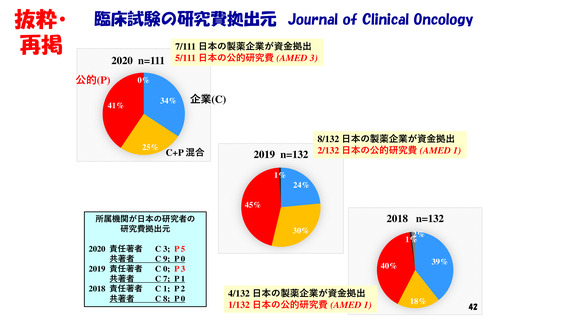
・著名学術雑誌において
我が国の研究者が責任著者になっている
臨床試験結果の原著論文数は、世界全体の5%前後。
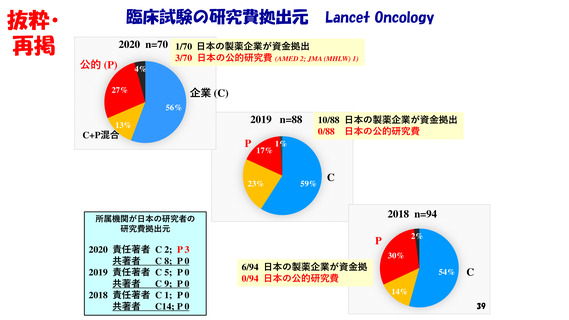
しかも、それらの試験の大半は海外製薬企業が資金拠出。
また、臨床試験の研究費拠出元になっている
日本の公的機関ならびに製薬企業は少ない。
2020年10月2日第79回日本癌学会学術総会(広島) PD-6で使用したものの抜粋日本語訳版
6
・PMDAの審査に要する期間は世界最速レベルを維持しているが
抗がん剤のドラッグ・ラグは拡大。
要因のひとつに、
日本法人や国内管理人を持たない企業
(Emerging Biopharma; EBP)が
多くの抗がん剤開発を担っているため、
わが国での開発を行ってくれていない実態がある。
・著名学術雑誌において
我が国の研究者が責任著者になっている
臨床試験結果の原著論文数は、世界全体の5%前後。
しかも、それらの試験の大半は海外製薬企業が資金拠出。
また、臨床試験の研究費拠出元になっている
日本の公的機関ならびに製薬企業は少ない。
2020年10月2日第79回日本癌学会学術総会(広島) PD-6で使用したものの抜粋日本語訳版
6