よむ、つかう、まなぶ。
資料2-7_藤原参考人提出資料 (44 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_33877.html |
| 出典情報 | 今後のがん研究のあり方に関する有識者会議(第12回 6/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
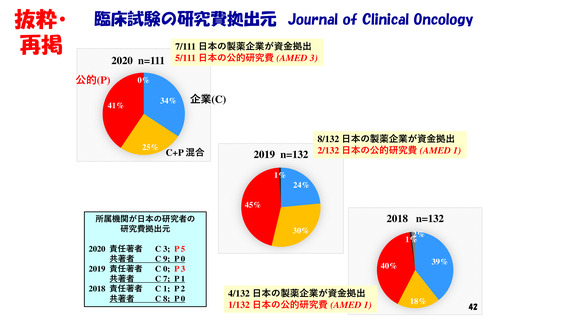
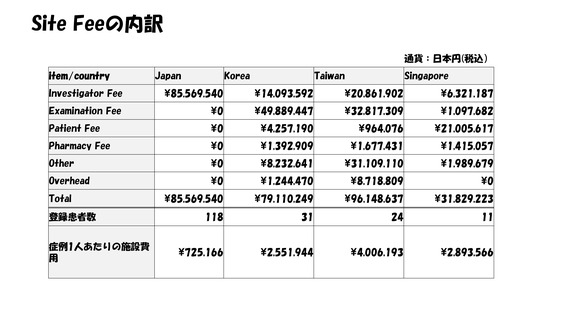
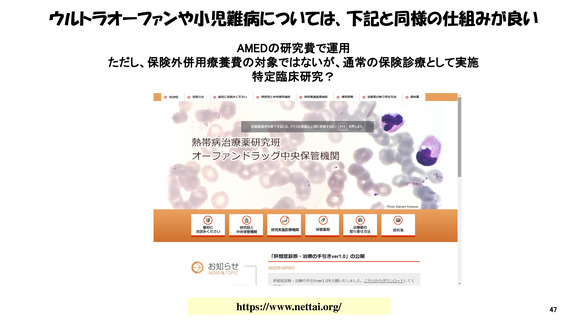
抜粋・ 我が国の医薬品の研究開発の課題&解決策(私見)①
再掲 • “特定臨床研究“の呪縛からの脱却: ”臨床試験”の規制効率化
✓ 治験も臨床試験も欧米では同じ”clinical trials”のカテゴリ。実施主体別に似て非
なる複数の規制を行う現状は非効率。規制自体は一元化した上で、個々の試験
のリスクレベル(risk-basedの原則)と試験の目的(fit-for-purposeの原則)によっ
て強弱をつける運用が安全かつ効率的。
✓ “臨床試験”を“臨床研究”と呼ぶ習慣から卒業する時期。
• 国内あるいはアジア圏でEBPが臨床試験・臨床開発をやりたくなる環境整備
✓ 臨床試験に対する国際整合性の低い複雑な国内規制(臨床研究法)の見直し
✓ 創薬型ベンチャーへの投資に未だに不慣れな国内機関投資家の体質などを改善
(参照 伊藤レポート2.0 ~バイオメディカル産業版~ 「バイオベンチャーと投資家の対話促進研究会」
報告書 2019年7月18日 改訂版 経済産業省)
• シーズ開発偏重のAMED, JSPS等の研究費投入から決別し、ライフスパンを
俯瞰した息の長い研究費投入
✓ 文科、厚労両省がこれまで実施してきた、translationalからphase 1までの期間に
焦点を当てたシーズ開発促進施策は一定の結果を出したが、大学内にシーズ開
発偏重傾向を生み出した。現在の開発の「死の谷」は「phase 2以降の実用化プロ
セスに移行。この新たな「死の谷」については、AROに対応を丸投げの状況。
13
再掲 • “特定臨床研究“の呪縛からの脱却: ”臨床試験”の規制効率化
✓ 治験も臨床試験も欧米では同じ”clinical trials”のカテゴリ。実施主体別に似て非
なる複数の規制を行う現状は非効率。規制自体は一元化した上で、個々の試験
のリスクレベル(risk-basedの原則)と試験の目的(fit-for-purposeの原則)によっ
て強弱をつける運用が安全かつ効率的。
✓ “臨床試験”を“臨床研究”と呼ぶ習慣から卒業する時期。
• 国内あるいはアジア圏でEBPが臨床試験・臨床開発をやりたくなる環境整備
✓ 臨床試験に対する国際整合性の低い複雑な国内規制(臨床研究法)の見直し
✓ 創薬型ベンチャーへの投資に未だに不慣れな国内機関投資家の体質などを改善
(参照 伊藤レポート2.0 ~バイオメディカル産業版~ 「バイオベンチャーと投資家の対話促進研究会」
報告書 2019年7月18日 改訂版 経済産業省)
• シーズ開発偏重のAMED, JSPS等の研究費投入から決別し、ライフスパンを
俯瞰した息の長い研究費投入
✓ 文科、厚労両省がこれまで実施してきた、translationalからphase 1までの期間に
焦点を当てたシーズ開発促進施策は一定の結果を出したが、大学内にシーズ開
発偏重傾向を生み出した。現在の開発の「死の谷」は「phase 2以降の実用化プロ
セスに移行。この新たな「死の谷」については、AROに対応を丸投げの状況。
13