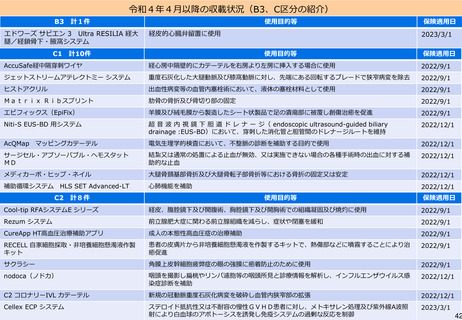
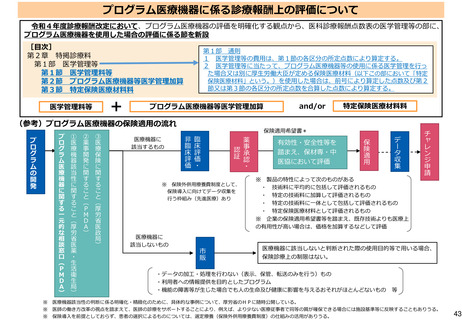
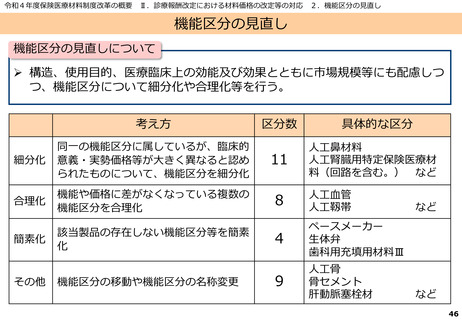
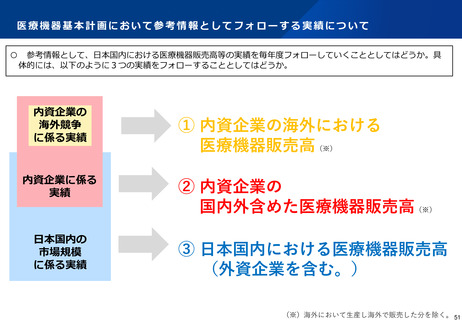
よむ、つかう、まなぶ。
資料3-2 医療機器基本計画に関するKPIの策定について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi/other-isei_256018.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第3回 3/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
CIN(クリニカル・イノベーション・ネットワーク)基本方針
平成29年3月22日
臨床開発環境整備推進会議
了承
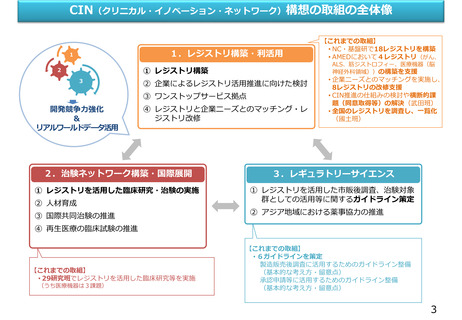
○目標
• レギュラトリーサイエンスに基づき、疾患登録システムを活用した革新的な医薬品等の開発環境を整備することにより、我
が国の医薬品・医療機器等の開発競争力を強化する。
• 透明性及び個人情報に配慮した上で、診療で得られるリアルワールドデータを収集・解析する体制・システムを整備し、創
薬や医療の場で有効に活用する。
• 以上により、新薬等を速やかに国民に提供することを通じて、健康寿命を延伸する。
○基本方針
• 疾患登録システムを活用した効率的な治験・市販後調査・臨床研究体制の構築を推進し、我が国発の医薬品・医療機器等の
開発を促進するため、以下の取組を行う。
1) 我が国で整備が進む疾患登録システムに関する情報を整理するとともに、治験・市販後調査・臨床研究を推進するため
の課題解決を行う体制を構築する。
2) レギュラトリーサイエンス研究に基づき、海外の規制当局の動向も踏まえて、疾患登録システムを治験・市販後調査に
活用するための国際連携等の環境整備を行う。疾患登録システムの要件(用途別)及び信頼性基準の確立とそれに基づ
いて、薬事承認・再審査に疾患登録システムを用いるためのガイドラインを策定する。
3) 検証結果を踏まえ、受益者負担による疾患登録システムの維持管理体制を構築する。
○各年次 重点項目
2016 連携体制の整備
横串研究班(武田班、林班)の設置、NC-WG、PMDA-WG、AMEDシンポジウムの開催
2017 レギュラトリーサイエンスに基づいた疾患登録システムの構築
市販後調査及び治験対照群としての活用を目指した新たなレジストリの構築(2016年度に医薬品3課題、医療機器1課
題を採択)
承認審査に資する疾患登録システムの評価基準の検討
ワンストップサービス拠点の整備を開始
2018 臨床研究・治験の推進
2020のガイドライン作成等に資する検証的臨床研究・治験を実施
2019 疾患登録システムの自立化に向けた検討
疾患登録システムの自立化に向けた検討、ターゲット年度に向け疾患登録システムのデータ登録等を加速
2020 ガイドライン等の作成
疾患登録情報を活用した治験・臨床研究に関するガイドライン等の作成
1
平成29年3月22日
臨床開発環境整備推進会議
了承
○目標
• レギュラトリーサイエンスに基づき、疾患登録システムを活用した革新的な医薬品等の開発環境を整備することにより、我
が国の医薬品・医療機器等の開発競争力を強化する。
• 透明性及び個人情報に配慮した上で、診療で得られるリアルワールドデータを収集・解析する体制・システムを整備し、創
薬や医療の場で有効に活用する。
• 以上により、新薬等を速やかに国民に提供することを通じて、健康寿命を延伸する。
○基本方針
• 疾患登録システムを活用した効率的な治験・市販後調査・臨床研究体制の構築を推進し、我が国発の医薬品・医療機器等の
開発を促進するため、以下の取組を行う。
1) 我が国で整備が進む疾患登録システムに関する情報を整理するとともに、治験・市販後調査・臨床研究を推進するため
の課題解決を行う体制を構築する。
2) レギュラトリーサイエンス研究に基づき、海外の規制当局の動向も踏まえて、疾患登録システムを治験・市販後調査に
活用するための国際連携等の環境整備を行う。疾患登録システムの要件(用途別)及び信頼性基準の確立とそれに基づ
いて、薬事承認・再審査に疾患登録システムを用いるためのガイドラインを策定する。
3) 検証結果を踏まえ、受益者負担による疾患登録システムの維持管理体制を構築する。
○各年次 重点項目
2016 連携体制の整備
横串研究班(武田班、林班)の設置、NC-WG、PMDA-WG、AMEDシンポジウムの開催
2017 レギュラトリーサイエンスに基づいた疾患登録システムの構築
市販後調査及び治験対照群としての活用を目指した新たなレジストリの構築(2016年度に医薬品3課題、医療機器1課
題を採択)
承認審査に資する疾患登録システムの評価基準の検討
ワンストップサービス拠点の整備を開始
2018 臨床研究・治験の推進
2020のガイドライン作成等に資する検証的臨床研究・治験を実施
2019 疾患登録システムの自立化に向けた検討
疾患登録システムの自立化に向けた検討、ターゲット年度に向け疾患登録システムのデータ登録等を加速
2020 ガイドライン等の作成
疾患登録情報を活用した治験・臨床研究に関するガイドライン等の作成
1