よむ、つかう、まなぶ。
資料2.緊急時の薬事承認の在り方 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_22281.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和3度第1回 11/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
制度設計に当たっての論点
新たな制度の主な論点は以下のとおり。
1. 発動の要件
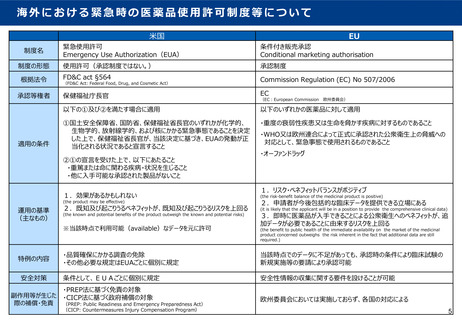
○ 米国EUAでは、「化学的、生物学的、放射線学的又は核にかかる緊急事態であり、緊急事態の原因となっ
たものが重篤または命に関わる疾病・状況を生じること」とされている。
○ 我が国の特例承認制度では、「国民の生命及び健康に重大な影響を与えるおそれがある疾病のまん延その
他の健康被害の拡大を防止するために緊急に使用されることが必要な医薬品等であり、他に代替手段が存在
しない」ことと規定されており、当該規定では、以下の状況を想定している。
・感染症のアウトブレイク(現下の新型コロナウィルス感染症、2009年の新型インフルエンザ感染症等)に加え、
原子力事故、バイオテロ等も含む幅広い状況
・治療薬がまだ存在しない状況のみならず、我が国で承認済みの医薬品のみでは緊急時の医療上の必要性を満たせな
い場合を含む幅広い状況
✔ 緊急時の薬事承認制度の発動の要件として、現在の特例承認制度と同等の状況を想定してはどうか。
2. 運用の基準
○ 米国EUAでは、有効性があるらしいこと(may be effective)、既知及び想定される(known and
potential)ベネフィットがリスクを上回ることとされている。
○ 我が国では、原則として、有効性が認められ(有効性を確認)、有効性に比して著しく有害な作用を有しない
と認められる場合(安全性を確認)とされている。ただし、再生医療等製品のうち品質が均質でないものについ
ては、再生医療等製品の条件・期限付き承認制度により、有効性が推定される場合に承認することができる。
✔ 緊急時においては、有効性・安全性について、平時とは異なる承認の考え方が必要ではないか。
✔ 緊急時においては、承認に必要なデータについて、平時とは異なる考え方が必要ではないか。
7
新たな制度の主な論点は以下のとおり。
1. 発動の要件
○ 米国EUAでは、「化学的、生物学的、放射線学的又は核にかかる緊急事態であり、緊急事態の原因となっ
たものが重篤または命に関わる疾病・状況を生じること」とされている。
○ 我が国の特例承認制度では、「国民の生命及び健康に重大な影響を与えるおそれがある疾病のまん延その
他の健康被害の拡大を防止するために緊急に使用されることが必要な医薬品等であり、他に代替手段が存在
しない」ことと規定されており、当該規定では、以下の状況を想定している。
・感染症のアウトブレイク(現下の新型コロナウィルス感染症、2009年の新型インフルエンザ感染症等)に加え、
原子力事故、バイオテロ等も含む幅広い状況
・治療薬がまだ存在しない状況のみならず、我が国で承認済みの医薬品のみでは緊急時の医療上の必要性を満たせな
い場合を含む幅広い状況
✔ 緊急時の薬事承認制度の発動の要件として、現在の特例承認制度と同等の状況を想定してはどうか。
2. 運用の基準
○ 米国EUAでは、有効性があるらしいこと(may be effective)、既知及び想定される(known and
potential)ベネフィットがリスクを上回ることとされている。
○ 我が国では、原則として、有効性が認められ(有効性を確認)、有効性に比して著しく有害な作用を有しない
と認められる場合(安全性を確認)とされている。ただし、再生医療等製品のうち品質が均質でないものについ
ては、再生医療等製品の条件・期限付き承認制度により、有効性が推定される場合に承認することができる。
✔ 緊急時においては、有効性・安全性について、平時とは異なる承認の考え方が必要ではないか。
✔ 緊急時においては、承認に必要なデータについて、平時とは異なる考え方が必要ではないか。
7