よむ、つかう、まなぶ。
資料1.医薬行政の最近の動き (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_22281.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和3度第1回 11/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
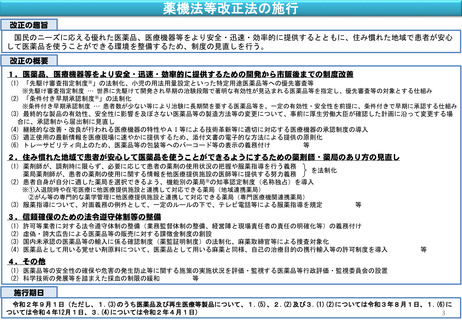
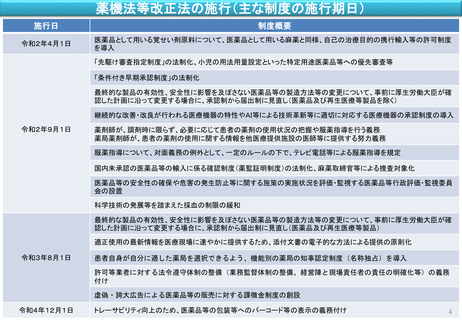
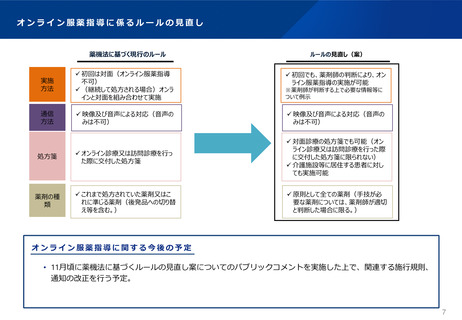
薬機法等改正法の施行(主な制度の施行期日)
施行日
制度概要
令和2年4月1日
医薬品として用いる覚せい剤原料について、医薬品として用いる麻薬と同様、自己の治療目的の携行輸入等の許可制度
を導入
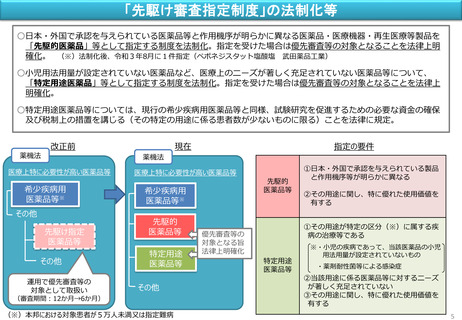
「先駆け審査指定制度」の法制化、小児の用法用量設定といった特定用途医薬品等への優先審査等
「条件付き早期承認制度」の法制化
最終的な製品の有効性、安全性に影響を及ぼさない医薬品等の製造方法等の変更について、事前に厚生労働大臣が確
認した計画に沿って変更する場合に、承認制から届出制に見直し(医薬品及び再生医療等製品を除く)
継続的な改善・改良が行われる医療機器の特性やAI等による技術革新等に適切に対応する医療機器の承認制度の導入
令和2年9月1日
薬剤師が、調剤時に限らず、必要に応じて患者の薬剤の使用状況の把握や服薬指導を行う義務
薬局薬剤師が、患者の薬剤の使用に関する情報を他医療提供施設の医師等に提供する努力義務
服薬指導について、対面義務の例外として、一定のルールの下で、テレビ電話等による服薬指導を規定
国内未承認の医薬品等の輸入に係る確認制度(薬監証明制度)の法制化、麻薬取締官等による捜査対象化
医薬品等の安全性の確保や危害の発生防止等に関する施策の実施状況を評価・監視する医薬品等行政評価・監視委員
会の設置
科学技術の発展等を踏まえた採血の制限の緩和
最終的な製品の有効性、安全性に影響を及ぼさない医薬品等の製造方法等の変更について、事前に厚生労働大臣が確
認した計画に沿って変更する場合に、承認制から届出制に見直し(医薬品及び再生医療等製品)
適正使用の最新情報を医療現場に速やかに提供するため、添付文書の電子的な方法による提供の原則化
令和3年8月1日
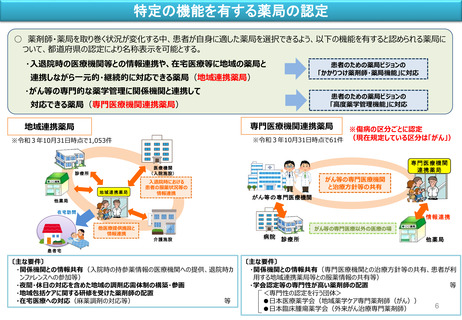
患者自身が自分に適した薬局を選択できるよう、機能別の薬局の知事認定制度(名称独占)を導入
許可等業者に対する法令遵守体制の整備(業務監督体制の整備、経営陣と現場責任者の責任の明確化等)の義務
付け
虚偽・誇大広告による医薬品等の販売に対する課徴金制度の創設
令和4年12月1日
トレーサビリティ向上のため、医薬品等の包装等へのバーコード等の表示の義務付け
4
施行日
制度概要
令和2年4月1日
医薬品として用いる覚せい剤原料について、医薬品として用いる麻薬と同様、自己の治療目的の携行輸入等の許可制度
を導入
「先駆け審査指定制度」の法制化、小児の用法用量設定といった特定用途医薬品等への優先審査等
「条件付き早期承認制度」の法制化
最終的な製品の有効性、安全性に影響を及ぼさない医薬品等の製造方法等の変更について、事前に厚生労働大臣が確
認した計画に沿って変更する場合に、承認制から届出制に見直し(医薬品及び再生医療等製品を除く)
継続的な改善・改良が行われる医療機器の特性やAI等による技術革新等に適切に対応する医療機器の承認制度の導入
令和2年9月1日
薬剤師が、調剤時に限らず、必要に応じて患者の薬剤の使用状況の把握や服薬指導を行う義務
薬局薬剤師が、患者の薬剤の使用に関する情報を他医療提供施設の医師等に提供する努力義務
服薬指導について、対面義務の例外として、一定のルールの下で、テレビ電話等による服薬指導を規定
国内未承認の医薬品等の輸入に係る確認制度(薬監証明制度)の法制化、麻薬取締官等による捜査対象化
医薬品等の安全性の確保や危害の発生防止等に関する施策の実施状況を評価・監視する医薬品等行政評価・監視委員
会の設置
科学技術の発展等を踏まえた採血の制限の緩和
最終的な製品の有効性、安全性に影響を及ぼさない医薬品等の製造方法等の変更について、事前に厚生労働大臣が確
認した計画に沿って変更する場合に、承認制から届出制に見直し(医薬品及び再生医療等製品)
適正使用の最新情報を医療現場に速やかに提供するため、添付文書の電子的な方法による提供の原則化
令和3年8月1日
患者自身が自分に適した薬局を選択できるよう、機能別の薬局の知事認定制度(名称独占)を導入
許可等業者に対する法令遵守体制の整備(業務監督体制の整備、経営陣と現場責任者の責任の明確化等)の義務
付け
虚偽・誇大広告による医薬品等の販売に対する課徴金制度の創設
令和4年12月1日
トレーサビリティ向上のため、医薬品等の包装等へのバーコード等の表示の義務付け
4
関連画像
ページ内で利用されている画像ファイルです。
有料会員登録をして頂くことで、このページ内で利用されている画像を個別に閲覧・ダウンロードすることができるようになります。