よむ、つかう、まなぶ。
資料3-2 ヒドロキシエチルデンプン調査結果報告書 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29975.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第22回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ること
•
腎代替療法(Renal Replacement Therapy。以下、
「RRT」)導入又は腎機能障害発現リスクの上
昇が認められていること
•
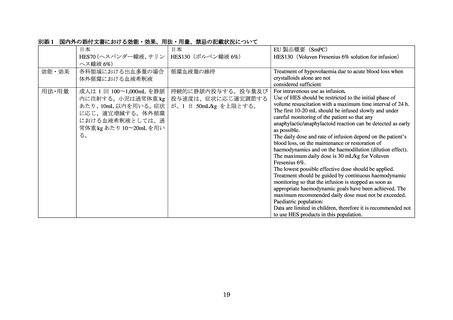
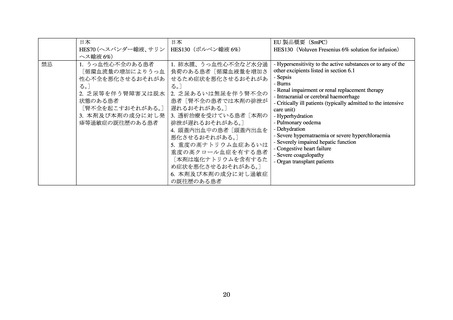
熱傷患者への HES 製剤の使用を支持するデータが不十分であること
しかしながら、製造販売承認取得者による要請を受けて PRAC による再評価が実施され、最終
的に、敗血症患者、熱傷患者、集中治療室(以下、
「ICU」)入院患者等の重症患者を禁忌としたう
えで、急性失血による循環血液量減少に対して晶質液だけでは不十分と考えられる場合に使用を
限定されるべきとの使用制限や追加の試験を実施すること、医療従事者や患者に対して情報提供
を実施すること等を条件に販売が継続された。
なお、HES 製剤の EU 製品概要(以下、
「SmPC」
)の禁忌のうち、敗血症、熱傷患者、重症患者
のほか、重度の肝機能障害、重度の凝固障害、脱水患者、臓器移植患者、腎不全又は腎代替療法
を受けている患者が 2013 年の PRAC の評価により設定され、それぞれの禁忌の設定根拠は以下
のとおりである。
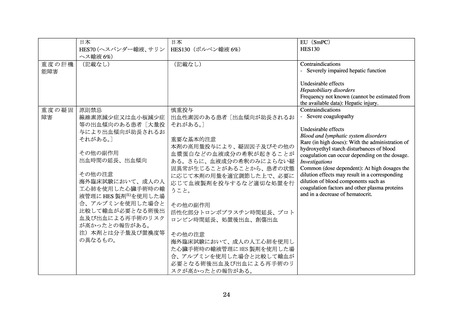
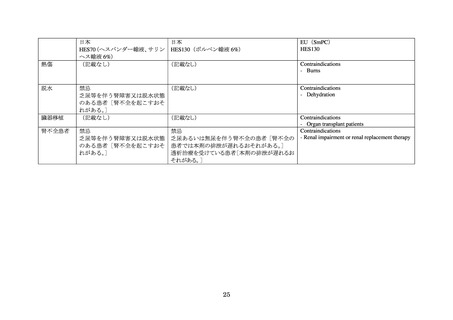
重度の肝機能障害患者:根拠の詳細は不明である。なお、HES130 以外の複数の HES 製剤の
製品情報には、改訂以前より重度の肝機能障害を有する患者への禁忌が含まれていた。
重度の凝固障害患者:臨床試験において HES が凝固系と相互作用し、高分子量及び低分子
量の HES で出血傾向が増加することが示されたことによるものである。
脱水患者:根拠の詳細は不明である。
臓器移植患者:根拠の詳細は不明である。
腎不全又は腎代替療法を受けている患者:根拠の詳細は、不明である。なお、改訂以前は「乏
尿あるいは無尿を伴う腎不全の患者」が禁忌に含まれていた。
国内では、EU における PRAC の HES130 販売停止勧告がなされた 2013 年 6 月時点では、既承
認の HES70 が広く使用され、HES130 は製造販売承認されてはいたものの未発売という状況であ
った。HES130 の製造販売承認審査時においては、HES130 がすでに海外で広く使用されており、
「麻酔薬および麻酔関連薬使用ガイドライン」第 3 版
5)
においても敗血症患者に対する HES 製
剤の使用が可能と読み取れることを踏まえ、審査時点では敗血症患者に対する HES130 の使用を
禁忌とするまでの根拠はないものの、当該患者に対する積極的な使用を促さないよう、
「重要な基
本的注意」の項において、重症敗血症等の重症患者管理に HES130 を投与した場合には、患者の
状態を悪化させるおそれがあることから、治療上の有益性が危険性を上回る場合にのみ本剤を投
与するよう注意喚起されることとなった。また、腎機能に対する HES の影響については引き続き
製造販売後において調査することとなった。2013 年 6 月時点で EU における PRAC の販売承認停
止の勧告が発出された経緯を受け、国内では 2013 年 9 月に、海外臨床試験成績、国内製造販売承
認後に報告されたメタ解析を含む関連文献、国内外での副作用症例報告の状況を精査し、代用血
漿としての臨床的意義等を踏まえて HES 製剤に対する安全対策の必要性について検討を行った。
5)「麻酔薬および麻酔関連薬使用ガイドラインⅦ輸液・電解質液
第 3 版」日本麻酔科学会(2009-2010 年)
記載内容については 3.1 項参照(ガイドラインの改訂により該当部分の修正なし)
2
•
腎代替療法(Renal Replacement Therapy。以下、
「RRT」)導入又は腎機能障害発現リスクの上
昇が認められていること
•
熱傷患者への HES 製剤の使用を支持するデータが不十分であること
しかしながら、製造販売承認取得者による要請を受けて PRAC による再評価が実施され、最終
的に、敗血症患者、熱傷患者、集中治療室(以下、
「ICU」)入院患者等の重症患者を禁忌としたう
えで、急性失血による循環血液量減少に対して晶質液だけでは不十分と考えられる場合に使用を
限定されるべきとの使用制限や追加の試験を実施すること、医療従事者や患者に対して情報提供
を実施すること等を条件に販売が継続された。
なお、HES 製剤の EU 製品概要(以下、
「SmPC」
)の禁忌のうち、敗血症、熱傷患者、重症患者
のほか、重度の肝機能障害、重度の凝固障害、脱水患者、臓器移植患者、腎不全又は腎代替療法
を受けている患者が 2013 年の PRAC の評価により設定され、それぞれの禁忌の設定根拠は以下
のとおりである。
重度の肝機能障害患者:根拠の詳細は不明である。なお、HES130 以外の複数の HES 製剤の
製品情報には、改訂以前より重度の肝機能障害を有する患者への禁忌が含まれていた。
重度の凝固障害患者:臨床試験において HES が凝固系と相互作用し、高分子量及び低分子
量の HES で出血傾向が増加することが示されたことによるものである。
脱水患者:根拠の詳細は不明である。
臓器移植患者:根拠の詳細は不明である。
腎不全又は腎代替療法を受けている患者:根拠の詳細は、不明である。なお、改訂以前は「乏
尿あるいは無尿を伴う腎不全の患者」が禁忌に含まれていた。
国内では、EU における PRAC の HES130 販売停止勧告がなされた 2013 年 6 月時点では、既承
認の HES70 が広く使用され、HES130 は製造販売承認されてはいたものの未発売という状況であ
った。HES130 の製造販売承認審査時においては、HES130 がすでに海外で広く使用されており、
「麻酔薬および麻酔関連薬使用ガイドライン」第 3 版
5)
においても敗血症患者に対する HES 製
剤の使用が可能と読み取れることを踏まえ、審査時点では敗血症患者に対する HES130 の使用を
禁忌とするまでの根拠はないものの、当該患者に対する積極的な使用を促さないよう、
「重要な基
本的注意」の項において、重症敗血症等の重症患者管理に HES130 を投与した場合には、患者の
状態を悪化させるおそれがあることから、治療上の有益性が危険性を上回る場合にのみ本剤を投
与するよう注意喚起されることとなった。また、腎機能に対する HES の影響については引き続き
製造販売後において調査することとなった。2013 年 6 月時点で EU における PRAC の販売承認停
止の勧告が発出された経緯を受け、国内では 2013 年 9 月に、海外臨床試験成績、国内製造販売承
認後に報告されたメタ解析を含む関連文献、国内外での副作用症例報告の状況を精査し、代用血
漿としての臨床的意義等を踏まえて HES 製剤に対する安全対策の必要性について検討を行った。
5)「麻酔薬および麻酔関連薬使用ガイドラインⅦ輸液・電解質液
第 3 版」日本麻酔科学会(2009-2010 年)
記載内容については 3.1 項参照(ガイドラインの改訂により該当部分の修正なし)
2