よむ、つかう、まなぶ。
参考資料2:体外診断用医薬品の一般検査薬への転用について(平成26年12月25日付け薬食発1225第1号厚生労働省医薬食品局長通知) (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29413.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第8回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
参考2
一般用検査薬の承認審査等に係る運用について
平成26年12月5日
医療機器・体外診断薬部会
医薬品医療機器等法に基づく承認審査は、各企業からの申請に基づき行われてい
るが、一般用検査薬については、生活者が正しく使用できるよう、検査項目毎に使
用上の注意、使用方法や検出感度等について承認審査のための一定の基準を示して
おくことが必要となる。
そこで一般用検査薬への転用にあたっては、まず、検査項目について議論を行い、
一般用検査薬とすることについて合意が得られた検査項目について、各企業からの
申請に基づく承認審査を行うこととする。
〇具体的な手順
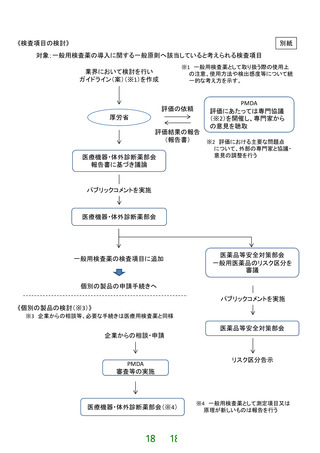
(1)検査項目の検討
①業界における検討
一般用検査薬の導入に関する一般原則への該当性や製品化の実現性等を踏
まえ、一般用検査薬として取り扱う際の使用上の注意、使用方法や検出感度等
を盛り込んだガイドライン(案)(※)を作成する。
※ガイドライン(案)に記載すべき事項等については関係者と調整の上、厚生労働省か
ら別途通知する。
②厚生労働省及び独立行政法人医薬品医療機器総合機構(PMDA)での評価
提出されたガイドライン(案)を元に、一般原則への該当性、使用方法や検
出感度等に関して科学的な観点から評価するとともに、使用上の注意等の記載
内容について評価を行う。
その際、専門協議(※)を開催し、専門家からの意見も聴取する。
※評価における主要な問題点について、外部の専門家と協議・意見の調整を行う
③医療機器・体外診断薬部会における議論
②での検討結果を踏まえ、議論を行い、その結果についてパブリックコメント
を実施する
《議論の視点》
ア)方法や性能等に関する事項
(具体例)
方法:試験紙、錠剤などで簡便に使用できるもの。
(測定用カップを添付して差し支え
ない。
)
性能:判定及びそれに関する説明は、例示のように表現を統一することが好ましい。
1
16 / 18
一般用検査薬の承認審査等に係る運用について
平成26年12月5日
医療機器・体外診断薬部会
医薬品医療機器等法に基づく承認審査は、各企業からの申請に基づき行われてい
るが、一般用検査薬については、生活者が正しく使用できるよう、検査項目毎に使
用上の注意、使用方法や検出感度等について承認審査のための一定の基準を示して
おくことが必要となる。
そこで一般用検査薬への転用にあたっては、まず、検査項目について議論を行い、
一般用検査薬とすることについて合意が得られた検査項目について、各企業からの
申請に基づく承認審査を行うこととする。
〇具体的な手順
(1)検査項目の検討
①業界における検討
一般用検査薬の導入に関する一般原則への該当性や製品化の実現性等を踏
まえ、一般用検査薬として取り扱う際の使用上の注意、使用方法や検出感度等
を盛り込んだガイドライン(案)(※)を作成する。
※ガイドライン(案)に記載すべき事項等については関係者と調整の上、厚生労働省か
ら別途通知する。
②厚生労働省及び独立行政法人医薬品医療機器総合機構(PMDA)での評価
提出されたガイドライン(案)を元に、一般原則への該当性、使用方法や検
出感度等に関して科学的な観点から評価するとともに、使用上の注意等の記載
内容について評価を行う。
その際、専門協議(※)を開催し、専門家からの意見も聴取する。
※評価における主要な問題点について、外部の専門家と協議・意見の調整を行う
③医療機器・体外診断薬部会における議論
②での検討結果を踏まえ、議論を行い、その結果についてパブリックコメント
を実施する
《議論の視点》
ア)方法や性能等に関する事項
(具体例)
方法:試験紙、錠剤などで簡便に使用できるもの。
(測定用カップを添付して差し支え
ない。
)
性能:判定及びそれに関する説明は、例示のように表現を統一することが好ましい。
1
16 / 18