よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
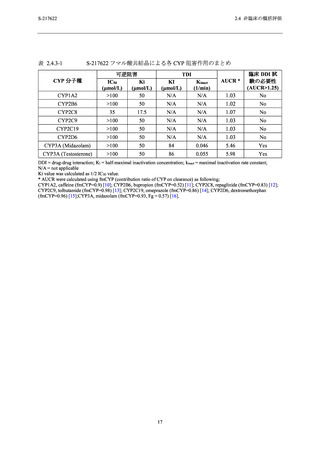
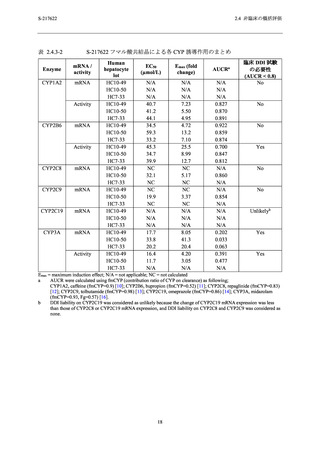
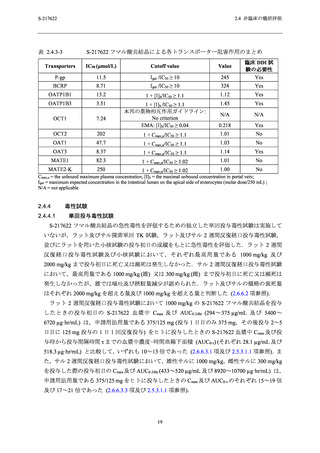
S-217622
●
2.4 非臨床の概括評価
赤血球系パラメータの減少
サル 2 週間反復経口投与毒性試験の 50 mg/kg/日以上の投与群及び 4 週間反復経口投与毒性試
験の 30 mg/kg/日投与群において,赤血球系パラメータ (赤血球数,ヘモグロビン濃度及びヘマ
トクリット値) の減少が認められた.一部の動物では網状赤血球数の増加又は骨髄における造
血反応を伴っていた.赤血球容積及び赤血球ヘモグロビン濃度に変動がないこと,血管内溶血
を示唆する変化 (アスパラギン酸アミノトランスフェラーゼ,乳酸脱水素酵素,尿色調等の変
動) を伴わなかったこと,脾臓でうっ血が認められたことから,30 mg/kg/日以上の投与群にお
いて認められた赤血球パラメータの減少は血管外溶血に起因すると考えられた.サル 2 週間及
び 4 週間反復経口投与毒性試験のいずれにおいても,投与期間中に認められた赤血球系パラ
メータの減少は休薬により回復した (2.6.6.3.3 項及び 2.6.6.3.4 項参照).
サル 4 週間反復経口投与毒性試験において 30 mg/kg/日投与群で認められた赤血球系パラメー
タの減少 (貧血) は,投与 11日目から 27 日目の間に発現したが,本剤の臨床予定投与期間は
5日間と短期である.また,上述したように,申請用法用量におけるヒト曝露量は,サル 4 週間
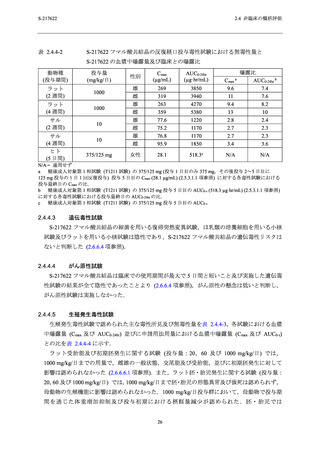
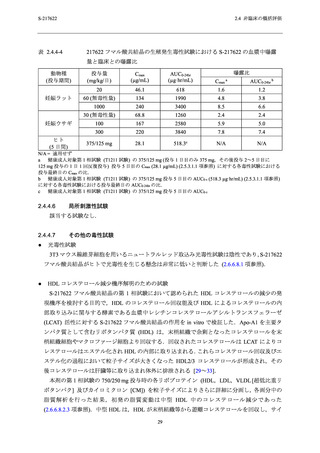
反復経口投与毒性試験の無毒性量における曝露量の範囲内 (Cmax:2.7~3.4 倍及び AUC0-24hr:2.3
~3.6 倍) であること (表 2.4.4-2),本剤の第 1 相及び第 2/3 相試験において,貧血やそれに関連
した有害事象は現時点では認められていないことから (2.5.5.2 項参照),申請用法用量では,貧
血やそれに関連した有害事象が起こる可能性は低いと考えられる.
●
血小板数の減少
サル 2 週間反復経口投与毒性試験の 50 mg/kg/日投与群の雌 1 例及び 1000/300/100 mg/kg/日投
与群の雄 1 例において,血小板数の減少が認められた.1000/300/100 mg/kg/日投与群の雄では,
骨髄において巨核球の増加が見られたことから,骨髄抑制作用を介した変化ではないと考えら
れた.50 mg/kg/日投与群の雌では骨髄巨核球数の変化や出血性変化を伴わず,軽度な変化であっ
た.休薬解剖例では血小板数の減少は認められなかったことから,回復性があると考えられた
(2.6.6.3.3 項参照).
サル 4 週間反復経口投与毒性試験では 30 mg/kg/日までの用量において,血小板数の減少は認
められなかった (2.6.6.3.4 項参照).
申請用法用量におけるヒト曝露量は,サル 4 週間反復経口投与毒性試験の無毒性量における
曝露量の範囲内 (Cmax:2.7~3.4 倍及び AUC0-24hr:2.3~3.6 倍) にあること (表 2.4.4-2),本剤の
第 1 相及び第 2/3 相試験において血小板数の減少やそれに関連した有害事象は現時点では認め
られていないことから (2.5.5.2 項参照),申請用法用量では,血小板数の減少やそれに関連した
有害事象が起こる可能性は低いと考えられる.
●
多臓器における炎症性変化
サル 2 週間反復経口投与毒性試験の 50 mg/kg/日以上の投与群において,脾臓及びリンパ節に
おける組織球及び形質細胞の増加,肺及び精巣上体の血管周囲並びに食道,涙腺,眼球 (結膜)
及び胆嚢の粘膜固有層に単核炎症細胞主体の炎症性細胞浸潤が認められた.また,サル 4 週間
反復経口投与毒性試験では 30 mg/kg/日までの用量において,雌 1 例で胆嚢及び子宮の筋層にお
23
●
2.4 非臨床の概括評価
赤血球系パラメータの減少
サル 2 週間反復経口投与毒性試験の 50 mg/kg/日以上の投与群及び 4 週間反復経口投与毒性試
験の 30 mg/kg/日投与群において,赤血球系パラメータ (赤血球数,ヘモグロビン濃度及びヘマ
トクリット値) の減少が認められた.一部の動物では網状赤血球数の増加又は骨髄における造
血反応を伴っていた.赤血球容積及び赤血球ヘモグロビン濃度に変動がないこと,血管内溶血
を示唆する変化 (アスパラギン酸アミノトランスフェラーゼ,乳酸脱水素酵素,尿色調等の変
動) を伴わなかったこと,脾臓でうっ血が認められたことから,30 mg/kg/日以上の投与群にお
いて認められた赤血球パラメータの減少は血管外溶血に起因すると考えられた.サル 2 週間及
び 4 週間反復経口投与毒性試験のいずれにおいても,投与期間中に認められた赤血球系パラ
メータの減少は休薬により回復した (2.6.6.3.3 項及び 2.6.6.3.4 項参照).
サル 4 週間反復経口投与毒性試験において 30 mg/kg/日投与群で認められた赤血球系パラメー
タの減少 (貧血) は,投与 11日目から 27 日目の間に発現したが,本剤の臨床予定投与期間は
5日間と短期である.また,上述したように,申請用法用量におけるヒト曝露量は,サル 4 週間
反復経口投与毒性試験の無毒性量における曝露量の範囲内 (Cmax:2.7~3.4 倍及び AUC0-24hr:2.3
~3.6 倍) であること (表 2.4.4-2),本剤の第 1 相及び第 2/3 相試験において,貧血やそれに関連
した有害事象は現時点では認められていないことから (2.5.5.2 項参照),申請用法用量では,貧
血やそれに関連した有害事象が起こる可能性は低いと考えられる.
●
血小板数の減少
サル 2 週間反復経口投与毒性試験の 50 mg/kg/日投与群の雌 1 例及び 1000/300/100 mg/kg/日投
与群の雄 1 例において,血小板数の減少が認められた.1000/300/100 mg/kg/日投与群の雄では,
骨髄において巨核球の増加が見られたことから,骨髄抑制作用を介した変化ではないと考えら
れた.50 mg/kg/日投与群の雌では骨髄巨核球数の変化や出血性変化を伴わず,軽度な変化であっ
た.休薬解剖例では血小板数の減少は認められなかったことから,回復性があると考えられた
(2.6.6.3.3 項参照).
サル 4 週間反復経口投与毒性試験では 30 mg/kg/日までの用量において,血小板数の減少は認
められなかった (2.6.6.3.4 項参照).
申請用法用量におけるヒト曝露量は,サル 4 週間反復経口投与毒性試験の無毒性量における
曝露量の範囲内 (Cmax:2.7~3.4 倍及び AUC0-24hr:2.3~3.6 倍) にあること (表 2.4.4-2),本剤の
第 1 相及び第 2/3 相試験において血小板数の減少やそれに関連した有害事象は現時点では認め
られていないことから (2.5.5.2 項参照),申請用法用量では,血小板数の減少やそれに関連した
有害事象が起こる可能性は低いと考えられる.
●
多臓器における炎症性変化
サル 2 週間反復経口投与毒性試験の 50 mg/kg/日以上の投与群において,脾臓及びリンパ節に
おける組織球及び形質細胞の増加,肺及び精巣上体の血管周囲並びに食道,涙腺,眼球 (結膜)
及び胆嚢の粘膜固有層に単核炎症細胞主体の炎症性細胞浸潤が認められた.また,サル 4 週間
反復経口投与毒性試験では 30 mg/kg/日までの用量において,雌 1 例で胆嚢及び子宮の筋層にお
23