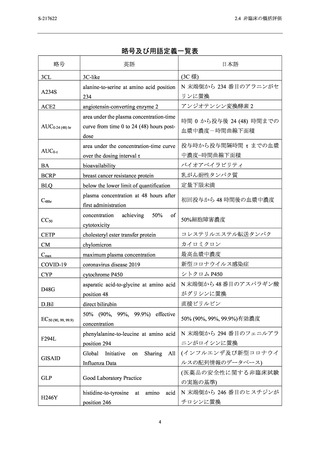
よむ、つかう、まなぶ。
【資料No.1】2.4_非臨床試験の概括資料 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
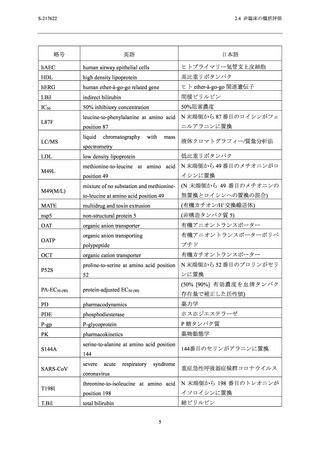
S-217622
2.4 非臨床の概括評価
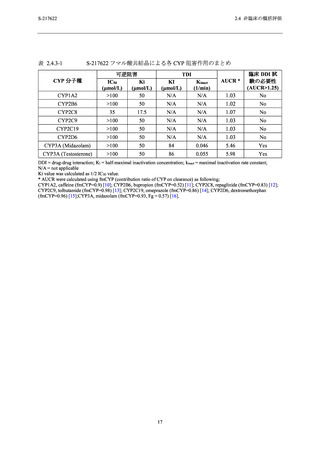
アデノシントランスポーターによるアデノシン取り込み作用に対する 50%阻害濃度 (IC50) は
1.43 µmol/L であった.また,ホスホジエステラーゼ (PDE) 4A1A,PDE4B1,PDE4C1 及び PDE4D2
の酵素活性に対する IC50 は,それぞれ 63.2,69.1,75.7 及び 73.4 µmol/L であった.その他の受
容体,イオンチャネル,トランスポーター及び酵素に対して 100 µmol/L (53.2 µg/mL) の濃度ま
で影響はなかった.
S-217622 フマル酸共結晶のアデノシントランスポーターに対する IC50 (1.43 µmol/L) は,申請
用法用量 (375/125 mg) における非結合型最高血漿中濃度 (Cmax) (1.2 µmol/L;総薬物濃度
[28.1 µg/mL],分子量 [531.88] 及びヒト血漿中タンパク結合率 [97.7%] から算出) の 1.2 倍で
あった (2.5.3.1.1 項及び 2.6.4.4.1.1 項参照).アデノシントランスポーターの阻害は,血中アデノ
シン濃度の上昇に繋がる可能性があり,アデノシンの主な薬理作用として中枢神経系 (睡眠導
入の低下)
,心血管系 (血圧及び心拍数の減少),血小板凝集の阻害及び免疫系 (抗炎症効果) へ
の影響が報告されている [6].しかしながら,安全性薬理試験 (2.6.2.4 項参照) 並びにラット及
びサルを用いた反復毒性試験 (2.6.6.3 項参照) において S-217622 フマル酸共結晶のアデノシン
トランスポーターの阻害に起因したと考えられる影響は認められなかった.さらに,第 1 相
(T1211 試験) 及び第 2/3 相試験 (T1221 試験) において,上述したような事象に関連する
S-217622 フマル酸共結晶投与に起因した有害事象は現時点では認められていない (2.5.5.2 項参
照).
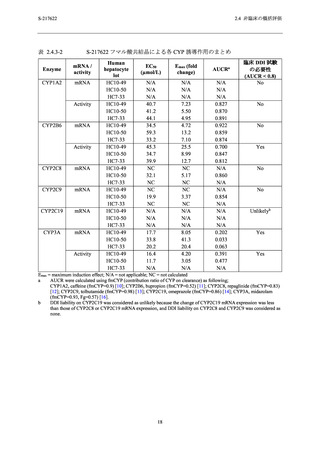
他に S-217622 フマル酸共結晶による 4 種のサブタイプの PDE4 阻害活性が認められたが,そ
の IC50 値 (63.2~75.7 µmol/L) は,申請用法用量における非結合型 Cmax (1.2 µmol/L) に対して
53~63 倍乖離しており,申請用法用量において非選択的 PDE4 阻害による懸念は低いと判断し
た.
異なるヒト組織に由来する 9 種の株化細胞及び 3 種のヒト初代培養細胞に対する CC50 は,い
ずれの細胞においても 72 µg/mL (135 µmol/L) 超える濃度と推定された (2.6.2.3.2 項及び 2.6.2.3.3
項参照).また,HepG2 細胞に対するミトコンドリア毒性は 300 µg/mL (564 µmol/L) まで認めら
れなかった (2.6.2.3.4 項参照).
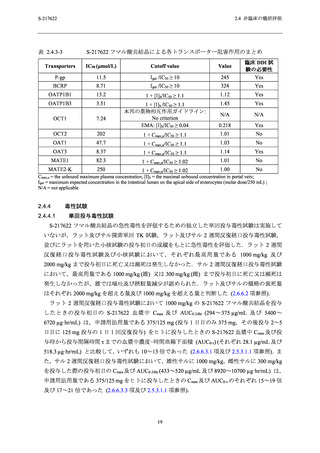
S-217622 フマル酸共結晶の各 SARS-CoV-2 株に対する EC50 (0.026
~0.52 µmol/L;2.6.2.2.1.2 項参照) との間に約 260 倍以上の十分な乖離がみられたことから,
S-217622 フマル酸共結晶のヒト由来細胞及びミトコンドリアへの障害性に対する懸念は低いと
判断した.
以上のことから,申請用法用量において S-217622 フマル酸共結晶投与に起因した副次的薬理
作用による副作用発現の懸念は低いと判断した.
2.4.2.3
安全性薬理試験
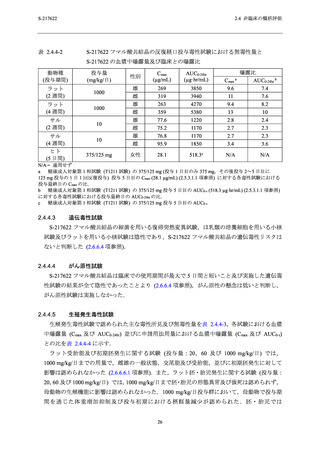
安全性薬理コアバッテリー試験として,S-217622 フマル酸共結晶の中枢神経系,心血管系及
び呼吸系に及ぼす影響を検討した.安全性薬理コアバッテリー試験の概要及び血漿中曝露量と
申請用法用量における血漿中曝露量との比を表 2.4.2-2 に示す.
12
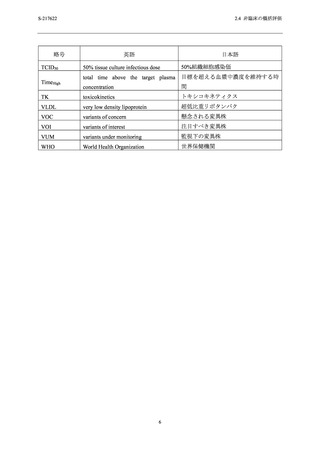
2.4 非臨床の概括評価
アデノシントランスポーターによるアデノシン取り込み作用に対する 50%阻害濃度 (IC50) は
1.43 µmol/L であった.また,ホスホジエステラーゼ (PDE) 4A1A,PDE4B1,PDE4C1 及び PDE4D2
の酵素活性に対する IC50 は,それぞれ 63.2,69.1,75.7 及び 73.4 µmol/L であった.その他の受
容体,イオンチャネル,トランスポーター及び酵素に対して 100 µmol/L (53.2 µg/mL) の濃度ま
で影響はなかった.
S-217622 フマル酸共結晶のアデノシントランスポーターに対する IC50 (1.43 µmol/L) は,申請
用法用量 (375/125 mg) における非結合型最高血漿中濃度 (Cmax) (1.2 µmol/L;総薬物濃度
[28.1 µg/mL],分子量 [531.88] 及びヒト血漿中タンパク結合率 [97.7%] から算出) の 1.2 倍で
あった (2.5.3.1.1 項及び 2.6.4.4.1.1 項参照).アデノシントランスポーターの阻害は,血中アデノ
シン濃度の上昇に繋がる可能性があり,アデノシンの主な薬理作用として中枢神経系 (睡眠導
入の低下)
,心血管系 (血圧及び心拍数の減少),血小板凝集の阻害及び免疫系 (抗炎症効果) へ
の影響が報告されている [6].しかしながら,安全性薬理試験 (2.6.2.4 項参照) 並びにラット及
びサルを用いた反復毒性試験 (2.6.6.3 項参照) において S-217622 フマル酸共結晶のアデノシン
トランスポーターの阻害に起因したと考えられる影響は認められなかった.さらに,第 1 相
(T1211 試験) 及び第 2/3 相試験 (T1221 試験) において,上述したような事象に関連する
S-217622 フマル酸共結晶投与に起因した有害事象は現時点では認められていない (2.5.5.2 項参
照).
他に S-217622 フマル酸共結晶による 4 種のサブタイプの PDE4 阻害活性が認められたが,そ
の IC50 値 (63.2~75.7 µmol/L) は,申請用法用量における非結合型 Cmax (1.2 µmol/L) に対して
53~63 倍乖離しており,申請用法用量において非選択的 PDE4 阻害による懸念は低いと判断し
た.
異なるヒト組織に由来する 9 種の株化細胞及び 3 種のヒト初代培養細胞に対する CC50 は,い
ずれの細胞においても 72 µg/mL (135 µmol/L) 超える濃度と推定された (2.6.2.3.2 項及び 2.6.2.3.3
項参照).また,HepG2 細胞に対するミトコンドリア毒性は 300 µg/mL (564 µmol/L) まで認めら
れなかった (2.6.2.3.4 項参照).
S-217622 フマル酸共結晶の各 SARS-CoV-2 株に対する EC50 (0.026
~0.52 µmol/L;2.6.2.2.1.2 項参照) との間に約 260 倍以上の十分な乖離がみられたことから,
S-217622 フマル酸共結晶のヒト由来細胞及びミトコンドリアへの障害性に対する懸念は低いと
判断した.
以上のことから,申請用法用量において S-217622 フマル酸共結晶投与に起因した副次的薬理
作用による副作用発現の懸念は低いと判断した.
2.4.2.3
安全性薬理試験
安全性薬理コアバッテリー試験として,S-217622 フマル酸共結晶の中枢神経系,心血管系及
び呼吸系に及ぼす影響を検討した.安全性薬理コアバッテリー試験の概要及び血漿中曝露量と
申請用法用量における血漿中曝露量との比を表 2.4.2-2 に示す.
12