よむ、つかう、まなぶ。
総-4-1○最適使用推進ガイドラインについて (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00168.html |
| 出典情報 | 中央社会保険医療協議会 総会(第531回 11/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
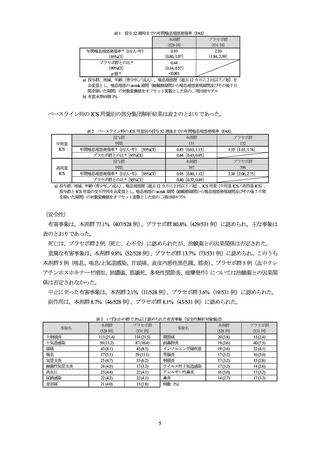
表 1 投与 52 週時までの年間喘息増悪発現率(FAS)
本剤群
プラセボ群
(528 例)
(531 例)
0.93
2.10
年間喘息増悪発現率 a)(回/人・年)
[0.80, 1.07]
[1.84, 2.39]
[95%CI]
プラセボ群との比 a)
0.44
[99%CI]
[0.34, 0.57]
<0.001
p 値 b)
a) 投与群、地域、年齢(青少年./成人)、喘息増悪歴(過去 12 カ月に 2 回以下/超)を
共変量とし、喘息増悪の at-risk 期間(総観察期間から喘息増悪発現期間及びその後 7 日
間を除いた期間)の対数変換値をオフセット変数とした負の二項回帰モデル
b) 有意水準両側 1%
ベースライン時の ICS 用量別の部分集団解析結果は表 2 のとおりであった。
表 2 ベースライン時の ICS 用量別の投与 52 週後までの年間喘息増悪発現率(FAS)
投与群
本剤群
プラセボ群
131
132
例数
中用量
ICS
年間喘息増悪発現率 a)(回/人・年)[95%CI]
0.85[0.63, 1.15]
1.33[1.01, 1.74]
プラセボ群との比 a)[95%CI]
0.64[0.43, 0.95]
投与群
本剤群
プラセボ群
397
398
例数
高用量
ICS
年間喘息増悪発現率 a)(回/人・年)[95%CI]
0.95[0.80, 1.12]
2.38[2.06, 2.75]
プラセボ群との比 a)[95%CI]
0.40[0.32, 0.49]
a) 投与群、地域、年齢(青少年./成人)、喘息増悪歴(過去 12 カ月に 2 回以下/超)、ICS 用量(中用量 ICS/高用量 ICS)、
投与群と ICS 用量の交互作用を共変量とし、喘息増悪の at-risk 期間(総観察期間から喘息増悪発現期間及びその後 7 日間
を除いた期間)の対数変換値をオフセット変数とした負の二項回帰モデル
(安全性)
有害事象は、本剤群 77.1%(407/528 例)
、プラセボ群 80.8%(429/531 例)に認められ、主な事象は
表のとおりであった。
死亡は、プラセボ群 2 例(死亡、心不全)に認められたが、治験薬との因果関係は否定された。
重篤な有害事象は、本剤群 9.8%(52/528 例)
、プラセボ群 13.7%(73/531 例)に認められ、このうち
本剤群 5 例(喘息、喘息/上気道感染、片頭痛、表皮内悪性黒色腫、筋炎)
、プラセボ群 5 例(血中クレ
アチンホスホキナーゼ増加、肺膿瘍、筋壊死、多発性関節炎、痙攣発作)については治験薬との因果関
係は否定されなかった。
中止に至った有害事象は、本剤群 2.1%(11/528 例)
、プラセボ群 3.6%(19/531 例)に認められた。
副作用は、本剤群 8.7%(46/528 例)
、プラセボ群 8.1%(43/531 例)に認められた。
事象名
上咽頭炎
上気道感染
頭痛
喘息
気管支炎
細菌性気管支炎
高血圧
尿路感染
背部痛
表 3 いずれかの群で 3%以上認められた有害事象(安全性解析対象集団)
本剤群
プラセボ群
本剤群
事象名
(528 例)
(531 例)
(528 例)
113 (21.4)
114 (21.5)
20 (3.8)
関節痛
59 (11.2)
87 (16.4)
19 (3.6)
副鼻腔炎
43 (8.1)
45 (8.5)
19 (3.6)
インフルエンザ様疾患
27 (5.1)
59 (11.1)
17 (3.2)
胃腸炎
25 (4.7)
33 (6.2)
17 (3.2)
咽頭炎
24 (4.5)
17 (3.2)
17 (3.2)
ウイルス性上気道感染
23 (4.4)
22 (4.1)
16 (3.0)
アレルギー性鼻炎
22 (4.2)
22 (4.1)
14 (2.7)
鼻炎
21 (4.0)
15 (2.8)
例数(%)
5
プラセボ群
(531 例)
13 (2.4)
40 (7.5)
22 (4.1)
16 (3.0)
15 (2.8)
14 (2.6)
17 (3.2)
17 (3.2)
本剤群
プラセボ群
(528 例)
(531 例)
0.93
2.10
年間喘息増悪発現率 a)(回/人・年)
[0.80, 1.07]
[1.84, 2.39]
[95%CI]
プラセボ群との比 a)
0.44
[99%CI]
[0.34, 0.57]
<0.001
p 値 b)
a) 投与群、地域、年齢(青少年./成人)、喘息増悪歴(過去 12 カ月に 2 回以下/超)を
共変量とし、喘息増悪の at-risk 期間(総観察期間から喘息増悪発現期間及びその後 7 日
間を除いた期間)の対数変換値をオフセット変数とした負の二項回帰モデル
b) 有意水準両側 1%
ベースライン時の ICS 用量別の部分集団解析結果は表 2 のとおりであった。
表 2 ベースライン時の ICS 用量別の投与 52 週後までの年間喘息増悪発現率(FAS)
投与群
本剤群
プラセボ群
131
132
例数
中用量
ICS
年間喘息増悪発現率 a)(回/人・年)[95%CI]
0.85[0.63, 1.15]
1.33[1.01, 1.74]
プラセボ群との比 a)[95%CI]
0.64[0.43, 0.95]
投与群
本剤群
プラセボ群
397
398
例数
高用量
ICS
年間喘息増悪発現率 a)(回/人・年)[95%CI]
0.95[0.80, 1.12]
2.38[2.06, 2.75]
プラセボ群との比 a)[95%CI]
0.40[0.32, 0.49]
a) 投与群、地域、年齢(青少年./成人)、喘息増悪歴(過去 12 カ月に 2 回以下/超)、ICS 用量(中用量 ICS/高用量 ICS)、
投与群と ICS 用量の交互作用を共変量とし、喘息増悪の at-risk 期間(総観察期間から喘息増悪発現期間及びその後 7 日間
を除いた期間)の対数変換値をオフセット変数とした負の二項回帰モデル
(安全性)
有害事象は、本剤群 77.1%(407/528 例)
、プラセボ群 80.8%(429/531 例)に認められ、主な事象は
表のとおりであった。
死亡は、プラセボ群 2 例(死亡、心不全)に認められたが、治験薬との因果関係は否定された。
重篤な有害事象は、本剤群 9.8%(52/528 例)
、プラセボ群 13.7%(73/531 例)に認められ、このうち
本剤群 5 例(喘息、喘息/上気道感染、片頭痛、表皮内悪性黒色腫、筋炎)
、プラセボ群 5 例(血中クレ
アチンホスホキナーゼ増加、肺膿瘍、筋壊死、多発性関節炎、痙攣発作)については治験薬との因果関
係は否定されなかった。
中止に至った有害事象は、本剤群 2.1%(11/528 例)
、プラセボ群 3.6%(19/531 例)に認められた。
副作用は、本剤群 8.7%(46/528 例)
、プラセボ群 8.1%(43/531 例)に認められた。
事象名
上咽頭炎
上気道感染
頭痛
喘息
気管支炎
細菌性気管支炎
高血圧
尿路感染
背部痛
表 3 いずれかの群で 3%以上認められた有害事象(安全性解析対象集団)
本剤群
プラセボ群
本剤群
事象名
(528 例)
(531 例)
(528 例)
113 (21.4)
114 (21.5)
20 (3.8)
関節痛
59 (11.2)
87 (16.4)
19 (3.6)
副鼻腔炎
43 (8.1)
45 (8.5)
19 (3.6)
インフルエンザ様疾患
27 (5.1)
59 (11.1)
17 (3.2)
胃腸炎
25 (4.7)
33 (6.2)
17 (3.2)
咽頭炎
24 (4.5)
17 (3.2)
17 (3.2)
ウイルス性上気道感染
23 (4.4)
22 (4.1)
16 (3.0)
アレルギー性鼻炎
22 (4.2)
22 (4.1)
14 (2.7)
鼻炎
21 (4.0)
15 (2.8)
例数(%)
5
プラセボ群
(531 例)
13 (2.4)
40 (7.5)
22 (4.1)
16 (3.0)
15 (2.8)
14 (2.6)
17 (3.2)
17 (3.2)