よむ、つかう、まなぶ。
再生医療等安全性確保法における原料及び細胞加工物の保管に関する管理基準の策定に資する研究 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_23718.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第72回 2/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
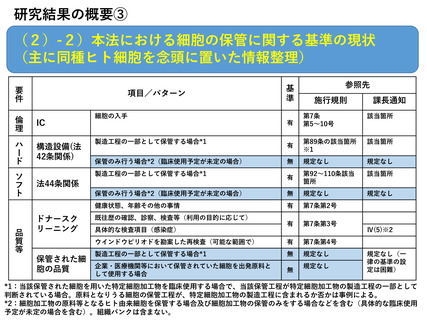
研究結果の概要③
(2)-2)本法における細胞の保管に関する基準の現状
(主に同種ヒト細胞を念頭に置いた情報整理)
要
件
項目/パターン
倫
理
IC
ハ
ー
ド
構造設備(法
42条関係)
ソ
フ
ト
品
質
等
細胞の入手
施行規則
課長通知
第7条
第5~10号
該当箇所
有
第89条の該当箇所
※1
該当箇所
無
規定なし
規定なし
有
第92~110条該当
箇所
該当箇所
保管のみ行う場合*2(臨床使用予定が未定の場合)
無
規定なし
規定なし
健康状態、年齢その他の事情
有
第7条第2号
有
第7条第3号
ウインドウピリオドを勘案した再検査(可能な範囲で)
有
第7条第4号
製造工程の一部として保管する場合*1
無
規定なし
企業・医療機関等において保管されていた細胞を出発原料と
して使用する場合
無
製造工程の一部として保管する場合*1
保管のみ行う場合*2(臨床使用予定が未定の場合)
法44条関係
保管された細
胞の品質
参照先
有
製造工程の一部として保管する場合*1
ドナースク
リーニング
基
準
既往歴の確認、診察、検査等(利用の目的に応じて)
具体的な検査項目(感染症)
規定なし
Ⅳ(5)※2
規定なし(一
律の基準の設
定は困難)
*1:当該保管された細胞を用いた特定細胞加工物を臨床使用する場合で、当該保管工程が特定細胞加工物の製造工程の一部として
判断されている場合。原料となりうる細胞の保管工程が、特定細胞加工物の製造工程に含まれるか否かは事例による。
*2:細胞加工物の原料等となるヒト由来細胞を保管する場合及び細胞加工物の保管のみをする場合などを含む(具体的な臨床使用
9
予定が未定の場合を含む)。組織バンクは含まない。
(2)-2)本法における細胞の保管に関する基準の現状
(主に同種ヒト細胞を念頭に置いた情報整理)
要
件
項目/パターン
倫
理
IC
ハ
ー
ド
構造設備(法
42条関係)
ソ
フ
ト
品
質
等
細胞の入手
施行規則
課長通知
第7条
第5~10号
該当箇所
有
第89条の該当箇所
※1
該当箇所
無
規定なし
規定なし
有
第92~110条該当
箇所
該当箇所
保管のみ行う場合*2(臨床使用予定が未定の場合)
無
規定なし
規定なし
健康状態、年齢その他の事情
有
第7条第2号
有
第7条第3号
ウインドウピリオドを勘案した再検査(可能な範囲で)
有
第7条第4号
製造工程の一部として保管する場合*1
無
規定なし
企業・医療機関等において保管されていた細胞を出発原料と
して使用する場合
無
製造工程の一部として保管する場合*1
保管のみ行う場合*2(臨床使用予定が未定の場合)
法44条関係
保管された細
胞の品質
参照先
有
製造工程の一部として保管する場合*1
ドナースク
リーニング
基
準
既往歴の確認、診察、検査等(利用の目的に応じて)
具体的な検査項目(感染症)
規定なし
Ⅳ(5)※2
規定なし(一
律の基準の設
定は困難)
*1:当該保管された細胞を用いた特定細胞加工物を臨床使用する場合で、当該保管工程が特定細胞加工物の製造工程の一部として
判断されている場合。原料となりうる細胞の保管工程が、特定細胞加工物の製造工程に含まれるか否かは事例による。
*2:細胞加工物の原料等となるヒト由来細胞を保管する場合及び細胞加工物の保管のみをする場合などを含む(具体的な臨床使用
9
予定が未定の場合を含む)。組織バンクは含まない。