よむ、つかう、まなぶ。
新型コロナウイルスワクチンの特例承認について プレスリリース (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28387.html |
| 出典情報 | 新型コロナウイルスワクチンの特例承認について(10/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
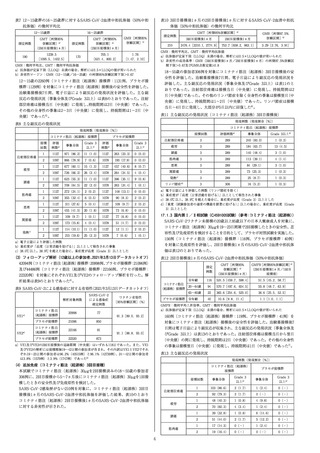
表2 6~23ヵ月群の16~25歳群に対するSARS-CoV-2血清中和抗体応答率の差
6~23ヵ月群(本剤3µg)
測定例数
na)
(抗体応答率[%]
)
[両側95%信頼区間] 測定例数
(3回目接種後1ヵ月)
80(100.0)
[95.5, 100.0]
80
2~4歳の小児参加者2750例(本剤接種群:1835例、プラセボ接種群:915例)
を対象に本剤接種後の安全性を評価した。治験薬接種後7日間、電子日誌によ
16~25歳群(本剤30µg)
差(%)
na)
(抗体応答率[%]
)[両側95%信頼区
[両側95%信頼区間]
間]b)
(2回目接種後1ヵ月)
168(98.8)
[95.8, 99.9]
170
り副反応の発現状況を評価し、主な副反応の発現状況(事象全体及びGrade
3以上)は表6のとおりであった4)。2~4歳の小児参加者において注射部位疼
痛は接種当日(中央値)に発現し、持続期間は1日(中央値)であった。そ
1.2
[-3.4, 4.2]
の他の全身性の事象は接種翌日~5日(中央値)に発現し、持続期間は1~2.5
日(中央値)であった5)。
a)抗体価がベースライン値(ベースライン値が定量下限(LLOQ)未満の場合はLLOQ値)
から4倍以上上昇した治験参加者数
b)免疫ブリッジングの成功基準:抗体応答率の差(6~23ヵ月 - 16~25歳)の両側95%信頼
区間の下限が>-10.0%
表6 2~4歳の小児参加者における主な副反応の発現状況
発現例数(発現割合[%])
本剤接種群
6~23ヵ月の小児参加者1776例(本剤接種群:1178例、プラセボ接種群:598
例)を対象に本剤接種後の安全性を評価した。治験薬接種後7日間、電子日
誌により副反応の発現状況を評価し、主な副反応の発現状況(事象全体及び
Grade 3以上)は表3のとおりであった4)。6~23ヵ月の小児参加者において注
注射部位
疼痛
射部位圧痛は接種当日(中央値)に発現し、持続期間は1日(中央値)であった。
その他の全身性の事象は接種翌日~4.5日(中央値)に発現し、持続期間は1
~2日(中央値)であった5)。
疲労
表3 6~23ヵ月の小児参加者における主な副反応の発現状況
発現例数(発現割合[%])
本剤接種群
接種
回数
1
注射部位
圧痛
2
3
1
食欲減退
2
3
1
傾眠
2
3
易刺激性
1159
1137
事象全体
192(16.6)
171(15.0)
362
1159
1137
1137
591
1(0.1)
590
0(-)
257(22.2)
252(22.2)
73(20.2)
170
3(0.3)
591
4(0.4)
590
4(1.1)
313(27.0)
271(23.8)
362
評価
例数a)
0(-)
58(16.0)
362
1159
プラセボ接種群
Grade 3
以上b)
72(19.9)
170
2(0.2)
591
4(0.4)
590
1(0.3)
170
事象全体
66(11.2)
50(8.5)
20(11.8)
125(21.2)
106(18.0)
23(13.5)
173(29.3)
125(21.2)
22(12.9)
頭痛
Grade 3
以上b)
0(-)
0(-)
1(0.2)
0(-)
2(0.3)
1(0.6)
593(51.2)
7(0.6)
591
279(47.2)
0(-)
1137
539(47.4)
7(0.6)
590
240(40.7)
5(0.8)
1(0.3)
170
64(37.6)
関節痛
1(0.2)
1159
158(43.6)
悪寒
1(0.2)
2
362
筋肉痛
0(-)
1
3
発熱c)
評価
例数a)
発熱c)
0(-)
接種
回数
評価
例数a)
1
2
事象全体
評価
例数a)
事象全体
Grade 3
以上b)
1814
559(30.8)
0(-)
905
186(20.6)
1(0.1)
1772
550(31.0)
0(-)
877
178(20.3)
1(0.1)
3
547
146(26.7)
0(-)
262
35(13.4)
0(-)
1
1813
539(29.7)
6(0.3)
905
277(30.6)
5(0.6)
2
1772
456(25.7)
8(0.5)
877
201(22.9)
3(0.3)
3
547
134(24.5)
2(0.4)
262
57(21.8)
0(-)
1
1813
81(4.5)
0(-)
905
44(4.9)
1(0.1)
2
1772
81(4.6)
0(-)
877
36(4.1)
1(0.1)
3
547
27(4.9)
0(-)
262
11(4.2)
0(-)
1
1813
43(2.4)
1(0.1)
905
15(1.7)
0(-)
2
1772
46(2.6)
0(-)
877
21(2.4)
0(-)
3
547
11(2.0)
0(-)
262
4(1.5)
0(-)
1
1813
41(2.3)
3(0.2)
905
22(2.4)
0(-)
2
1772
53(3.0)
0(-)
877
23(2.6)
0(-)
3
547
18(3.3)
1(0.2)
262
7(2.7)
0(-)
1
1813
14(0.8)
0(-)
905
18(2.0)
0(-)
2
1772
24(1.4)
0(-)
877
9(1.0)
0(-)
3
547
7(1.3)
1(0.2)
262
2(0.8)
0(-)
1
1824
95(5.2)
14(0.8)
909
48(5.3)
8(0.9)
2
1779
88(4.9)
21(1.2)
878
46(5.2)
8(0.9)
3
552
28(5.1)
4(0.7)
262
11(4.2)
3(1.1)
1
1173
85(7.2)
20(1.7)
595
43(7.2)
7(1.2)
2
1147
85(7.4)
24(2.1)
591
36(6.1)
7(1.2)
a)電子日誌により評価した例数
b)重症度が「高度(日常活動を妨げる)」以上として報告された事象
c)38.0℃以上。38.9℃を超えた場合に、重症度が高度(Grade 3)以上とした
3
365
25(6.8)
6(1.6)
170
10(5.9)
1(0.6)
17.1.2 海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591001試験)第Ⅱ/Ⅲ相パート(参考)
SARS-CoV-2ワクチン未接種の12歳以上の健康な参加者を対象に、本剤30µg
a)電子日誌により評価した例数
b)重症度が「高度(日常活動を妨げる)
」以上として報告された事象
c)38.0℃以上。38.9℃を超えた場合に、重症度が高度(Grade 3)以上とした
を19~23日間隔で2回接種したときの有効性及び安全性を検討することを目
的として、プラセボ対照無作為化多施設共同試験を実施した。
(2)2~4歳の小児参加者
16歳以上の参加者36523例(本剤接種群:18198例、プラセボ接種群:18325
本試験における2~4歳群(本剤3µg)のSARS-CoV-2感染歴がない143例及び
例)を対象に、1つ目の主要有効性評価項目である「SARS-CoV-2感染歴が
海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591001試験)における16~25歳群(本剤30µg)
ない参加者での2回目接種後7日以降のSARS-CoV-2による感染症に対する本
(17.1.2項参照)のSARS-CoV-2感染歴がない170例を対象に、本剤3回目接
剤の有効性[ワクチン有効性1(VE1)]」を評価した。40137例(本剤接種群:
種後1ヵ月のSARS-CoV-2血清中和抗体価及び抗体応答率を評価した結果、
19965例、プラセボ接種群:20172例)を対象に、2つ目の主要有効性評価項
表4及び表5のとおり本試験における2~4歳群(本剤3µg)の海外第Ⅰ/Ⅱ/
目である「SARS-CoV-2感染歴の有無を問わない参加者での2回目接種後7日
Ⅲ相試験(C4591001試験)における16~25歳群(本剤30µg)に対する免疫ブ
以降のSARS-CoV-2による感染症に対する本剤の有効性(VE2)」を評価した。
リッジングの成功基準を満たした4)。
解析結果は表7のとおりであった6)。
表4 2~4歳群の16~25歳群に対するSARS-CoV-2血清中和抗体価(50%中和抗
表7 SARS-CoV-2による感染症に対する有効性
体価)の幾何平均比
2~4歳群(本剤3µg)
GMT
測定例数 [両側95%信頼区間]a)
(3回目接種後1ヵ月)
143
1535.2
[1388.2, 1697.8]
解析対象
例数
16~25歳群(本剤30µg)
GMR
GMT
[両側95%信頼区
a)
測定例数 [両側95%信頼区間]
間]b)
(2回目接種後1ヵ月)
170
1180.0
[1066.6, 1305.4]
VE1a)
1.30
[1.13, 1.50]
VE2a)
GMR:幾何平均比、GMT:幾何平均抗体価
a)抗体価が定量下限(LLOQ)未満の場合、解析には0.5×LLOQの値が用いられた
b)免疫ブリッジングの成功基準:GMR(2~4歳/16~25歳)の両側95%信頼区間下限>0.67
及びGMR点推定値≥0.8
2~4歳群(本剤3µg)
141
16~25歳群(本剤30µg)
na)
(抗体応答率[%]
)
[両側95%信頼区間] 測定例数
(3回目接種後1ヵ月)
141(100.0)
[97.4, 100.0]
170
本剤接種群
18198
8
プラセボ接種群
18325
162
本剤接種群
19965
9
プラセボ接種群
20172
169
ワクチン有効性
[95%信用区間](%)
95.0[90.3, 97.6]
94.6[89.9, 97.3]
18. 薬効薬理
差(%)
na)
(抗体応答率[%]
)[両側95%信頼区
[両側95%信頼区間]
間]b)
(2回目接種後1ヵ月)
168(98.8)
[95.8, 99.9]
SARS-CoV-2
による感染症
確定例数
a)VE1及びVE2の2回目接種後の追跡期間(中央値)はそれぞれ57日と55日であった。また、
VE1及びVE2の解析には接種間隔19~42日間の参加者が含まれ、その内訳はVE1とVE2で
それぞれ19~23日間の参加者は96.5%(35248例)と96.3%(38665例)
、24~42日間の参
加者は3.5%(1275例)と3.7%(1472例)であった7)
表5 2~4歳群の16~25歳群に対するSARS-CoV-2血清中和抗体応答率の差
測定例数
プラセボ接種群
Grade 3
以上b)
18.1 作用機序
本剤に含有される修飾ウリジンメッセンジャーRNA(mRNA)は脂質ナノ粒
子に封入されており、それにより非複製性であるmRNAが宿主細胞に取り込
1.2
[-1.5, 4.2]
まれ、mRNAにコードされるSARS-CoV-2のスパイクタンパク質が一過性に
発現する。本剤接種によりスパイクタンパク質に対する中和抗体産生及び細
a)抗体価がベースライン値(ベースライン値が定量下限(LLOQ)未満の場合はLLOQ値)
から4倍以上上昇した治験参加者数
b)免疫ブリッジングの成功基準:抗体応答率の差(2~4歳 - 16~25歳)の両側95%信頼区
間の下限が>-10.0%
胞性免疫応答が誘導されることで、SARS-CoV-2による感染症の予防に寄与
すると考えられている。
3
6~23ヵ月群(本剤3µg)
測定例数
na)
(抗体応答率[%]
)
[両側95%信頼区間] 測定例数
(3回目接種後1ヵ月)
80(100.0)
[95.5, 100.0]
80
2~4歳の小児参加者2750例(本剤接種群:1835例、プラセボ接種群:915例)
を対象に本剤接種後の安全性を評価した。治験薬接種後7日間、電子日誌によ
16~25歳群(本剤30µg)
差(%)
na)
(抗体応答率[%]
)[両側95%信頼区
[両側95%信頼区間]
間]b)
(2回目接種後1ヵ月)
168(98.8)
[95.8, 99.9]
170
り副反応の発現状況を評価し、主な副反応の発現状況(事象全体及びGrade
3以上)は表6のとおりであった4)。2~4歳の小児参加者において注射部位疼
痛は接種当日(中央値)に発現し、持続期間は1日(中央値)であった。そ
1.2
[-3.4, 4.2]
の他の全身性の事象は接種翌日~5日(中央値)に発現し、持続期間は1~2.5
日(中央値)であった5)。
a)抗体価がベースライン値(ベースライン値が定量下限(LLOQ)未満の場合はLLOQ値)
から4倍以上上昇した治験参加者数
b)免疫ブリッジングの成功基準:抗体応答率の差(6~23ヵ月 - 16~25歳)の両側95%信頼
区間の下限が>-10.0%
表6 2~4歳の小児参加者における主な副反応の発現状況
発現例数(発現割合[%])
本剤接種群
6~23ヵ月の小児参加者1776例(本剤接種群:1178例、プラセボ接種群:598
例)を対象に本剤接種後の安全性を評価した。治験薬接種後7日間、電子日
誌により副反応の発現状況を評価し、主な副反応の発現状況(事象全体及び
Grade 3以上)は表3のとおりであった4)。6~23ヵ月の小児参加者において注
注射部位
疼痛
射部位圧痛は接種当日(中央値)に発現し、持続期間は1日(中央値)であった。
その他の全身性の事象は接種翌日~4.5日(中央値)に発現し、持続期間は1
~2日(中央値)であった5)。
疲労
表3 6~23ヵ月の小児参加者における主な副反応の発現状況
発現例数(発現割合[%])
本剤接種群
接種
回数
1
注射部位
圧痛
2
3
1
食欲減退
2
3
1
傾眠
2
3
易刺激性
1159
1137
事象全体
192(16.6)
171(15.0)
362
1159
1137
1137
591
1(0.1)
590
0(-)
257(22.2)
252(22.2)
73(20.2)
170
3(0.3)
591
4(0.4)
590
4(1.1)
313(27.0)
271(23.8)
362
評価
例数a)
0(-)
58(16.0)
362
1159
プラセボ接種群
Grade 3
以上b)
72(19.9)
170
2(0.2)
591
4(0.4)
590
1(0.3)
170
事象全体
66(11.2)
50(8.5)
20(11.8)
125(21.2)
106(18.0)
23(13.5)
173(29.3)
125(21.2)
22(12.9)
頭痛
Grade 3
以上b)
0(-)
0(-)
1(0.2)
0(-)
2(0.3)
1(0.6)
593(51.2)
7(0.6)
591
279(47.2)
0(-)
1137
539(47.4)
7(0.6)
590
240(40.7)
5(0.8)
1(0.3)
170
64(37.6)
関節痛
1(0.2)
1159
158(43.6)
悪寒
1(0.2)
2
362
筋肉痛
0(-)
1
3
発熱c)
評価
例数a)
発熱c)
0(-)
接種
回数
評価
例数a)
1
2
事象全体
評価
例数a)
事象全体
Grade 3
以上b)
1814
559(30.8)
0(-)
905
186(20.6)
1(0.1)
1772
550(31.0)
0(-)
877
178(20.3)
1(0.1)
3
547
146(26.7)
0(-)
262
35(13.4)
0(-)
1
1813
539(29.7)
6(0.3)
905
277(30.6)
5(0.6)
2
1772
456(25.7)
8(0.5)
877
201(22.9)
3(0.3)
3
547
134(24.5)
2(0.4)
262
57(21.8)
0(-)
1
1813
81(4.5)
0(-)
905
44(4.9)
1(0.1)
2
1772
81(4.6)
0(-)
877
36(4.1)
1(0.1)
3
547
27(4.9)
0(-)
262
11(4.2)
0(-)
1
1813
43(2.4)
1(0.1)
905
15(1.7)
0(-)
2
1772
46(2.6)
0(-)
877
21(2.4)
0(-)
3
547
11(2.0)
0(-)
262
4(1.5)
0(-)
1
1813
41(2.3)
3(0.2)
905
22(2.4)
0(-)
2
1772
53(3.0)
0(-)
877
23(2.6)
0(-)
3
547
18(3.3)
1(0.2)
262
7(2.7)
0(-)
1
1813
14(0.8)
0(-)
905
18(2.0)
0(-)
2
1772
24(1.4)
0(-)
877
9(1.0)
0(-)
3
547
7(1.3)
1(0.2)
262
2(0.8)
0(-)
1
1824
95(5.2)
14(0.8)
909
48(5.3)
8(0.9)
2
1779
88(4.9)
21(1.2)
878
46(5.2)
8(0.9)
3
552
28(5.1)
4(0.7)
262
11(4.2)
3(1.1)
1
1173
85(7.2)
20(1.7)
595
43(7.2)
7(1.2)
2
1147
85(7.4)
24(2.1)
591
36(6.1)
7(1.2)
a)電子日誌により評価した例数
b)重症度が「高度(日常活動を妨げる)」以上として報告された事象
c)38.0℃以上。38.9℃を超えた場合に、重症度が高度(Grade 3)以上とした
3
365
25(6.8)
6(1.6)
170
10(5.9)
1(0.6)
17.1.2 海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591001試験)第Ⅱ/Ⅲ相パート(参考)
SARS-CoV-2ワクチン未接種の12歳以上の健康な参加者を対象に、本剤30µg
a)電子日誌により評価した例数
b)重症度が「高度(日常活動を妨げる)
」以上として報告された事象
c)38.0℃以上。38.9℃を超えた場合に、重症度が高度(Grade 3)以上とした
を19~23日間隔で2回接種したときの有効性及び安全性を検討することを目
的として、プラセボ対照無作為化多施設共同試験を実施した。
(2)2~4歳の小児参加者
16歳以上の参加者36523例(本剤接種群:18198例、プラセボ接種群:18325
本試験における2~4歳群(本剤3µg)のSARS-CoV-2感染歴がない143例及び
例)を対象に、1つ目の主要有効性評価項目である「SARS-CoV-2感染歴が
海外第Ⅰ/Ⅱ/Ⅲ相試験(C4591001試験)における16~25歳群(本剤30µg)
ない参加者での2回目接種後7日以降のSARS-CoV-2による感染症に対する本
(17.1.2項参照)のSARS-CoV-2感染歴がない170例を対象に、本剤3回目接
剤の有効性[ワクチン有効性1(VE1)]」を評価した。40137例(本剤接種群:
種後1ヵ月のSARS-CoV-2血清中和抗体価及び抗体応答率を評価した結果、
19965例、プラセボ接種群:20172例)を対象に、2つ目の主要有効性評価項
表4及び表5のとおり本試験における2~4歳群(本剤3µg)の海外第Ⅰ/Ⅱ/
目である「SARS-CoV-2感染歴の有無を問わない参加者での2回目接種後7日
Ⅲ相試験(C4591001試験)における16~25歳群(本剤30µg)に対する免疫ブ
以降のSARS-CoV-2による感染症に対する本剤の有効性(VE2)」を評価した。
リッジングの成功基準を満たした4)。
解析結果は表7のとおりであった6)。
表4 2~4歳群の16~25歳群に対するSARS-CoV-2血清中和抗体価(50%中和抗
表7 SARS-CoV-2による感染症に対する有効性
体価)の幾何平均比
2~4歳群(本剤3µg)
GMT
測定例数 [両側95%信頼区間]a)
(3回目接種後1ヵ月)
143
1535.2
[1388.2, 1697.8]
解析対象
例数
16~25歳群(本剤30µg)
GMR
GMT
[両側95%信頼区
a)
測定例数 [両側95%信頼区間]
間]b)
(2回目接種後1ヵ月)
170
1180.0
[1066.6, 1305.4]
VE1a)
1.30
[1.13, 1.50]
VE2a)
GMR:幾何平均比、GMT:幾何平均抗体価
a)抗体価が定量下限(LLOQ)未満の場合、解析には0.5×LLOQの値が用いられた
b)免疫ブリッジングの成功基準:GMR(2~4歳/16~25歳)の両側95%信頼区間下限>0.67
及びGMR点推定値≥0.8
2~4歳群(本剤3µg)
141
16~25歳群(本剤30µg)
na)
(抗体応答率[%]
)
[両側95%信頼区間] 測定例数
(3回目接種後1ヵ月)
141(100.0)
[97.4, 100.0]
170
本剤接種群
18198
8
プラセボ接種群
18325
162
本剤接種群
19965
9
プラセボ接種群
20172
169
ワクチン有効性
[95%信用区間](%)
95.0[90.3, 97.6]
94.6[89.9, 97.3]
18. 薬効薬理
差(%)
na)
(抗体応答率[%]
)[両側95%信頼区
[両側95%信頼区間]
間]b)
(2回目接種後1ヵ月)
168(98.8)
[95.8, 99.9]
SARS-CoV-2
による感染症
確定例数
a)VE1及びVE2の2回目接種後の追跡期間(中央値)はそれぞれ57日と55日であった。また、
VE1及びVE2の解析には接種間隔19~42日間の参加者が含まれ、その内訳はVE1とVE2で
それぞれ19~23日間の参加者は96.5%(35248例)と96.3%(38665例)
、24~42日間の参
加者は3.5%(1275例)と3.7%(1472例)であった7)
表5 2~4歳群の16~25歳群に対するSARS-CoV-2血清中和抗体応答率の差
測定例数
プラセボ接種群
Grade 3
以上b)
18.1 作用機序
本剤に含有される修飾ウリジンメッセンジャーRNA(mRNA)は脂質ナノ粒
子に封入されており、それにより非複製性であるmRNAが宿主細胞に取り込
1.2
[-1.5, 4.2]
まれ、mRNAにコードされるSARS-CoV-2のスパイクタンパク質が一過性に
発現する。本剤接種によりスパイクタンパク質に対する中和抗体産生及び細
a)抗体価がベースライン値(ベースライン値が定量下限(LLOQ)未満の場合はLLOQ値)
から4倍以上上昇した治験参加者数
b)免疫ブリッジングの成功基準:抗体応答率の差(2~4歳 - 16~25歳)の両側95%信頼区
間の下限が>-10.0%
胞性免疫応答が誘導されることで、SARS-CoV-2による感染症の予防に寄与
すると考えられている。
3