よむ、つかう、まなぶ。
資料4-3 レボホリナートカルシウム (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00024.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第52回 8/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
例(10%)
、悪心及び疲労各7例(8%)
、貧血6例(7%)
、下痢4例(4%)
、脱水2例(2%)で
あった。FOLFOX群における治療関連死として、肺感染、口腔粘膜炎及び原因不明の突然死
各1例が認められた。
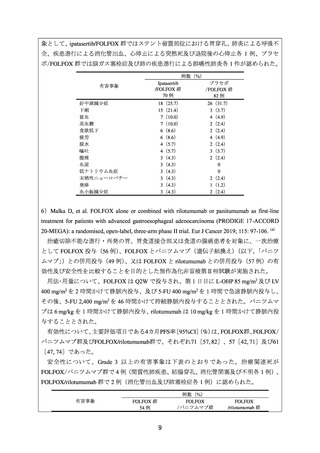
2)Enzinger PC, et al. CALGB 80403 (Alliance)/E1206: A Randomized Phase II Study of Three
Chemotherapy Regimens Plus Cetuximab in Metastatic Esophageal and Gastroesophageal Junction
Cancers. J Clin Oncol 2016; 34: 2736-42. 5)
治癒切除不能な食道又は食道胃接合部癌患者を対象に、セツキシマブ(遺伝子組換え)
(以下、「セツキシマブ」
)の併用下で、一次治療としての ECF(エピルビシン、シスプラ
チン及び 5-FU の併用)
(82 例)
、IC(IRI とシスプラチンとの併用)
(83 例)又は FOLFOX
(80 例)の有効性及び安全性を比較することを目的とした無作為化第Ⅱ相試験が実施され
た。
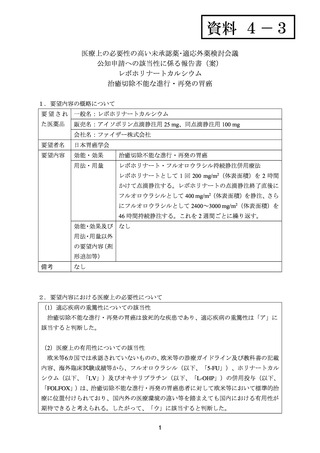
用法・用量について、下表のとおり投与することとされた。
レジメン
ECF
IC
FOLFOX
薬剤名
エピルビシン
シスプラチン
5-FU
シスプラチン
IRI
LV
5-FU
5-FU
L-OHP
セツキシマブ
投与量(投与時間)
50 mg/m2
60 mg/m2
200 mg/m2
30 mg/m2
65 mg/m2
400 mg/m2
400 mg/m2(急速静注)
2,400 mg/m2(46~48 時間)
85 mg/m2
400 mg/m2
250 mg/m2
投与方法
Day1
Q3W
Day 1~21
Day1 及び 8
Q3W
Day1
Q2W
Day1
Day1
1 サイクル目のみ
週1回
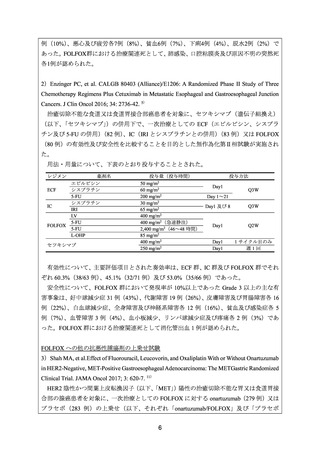
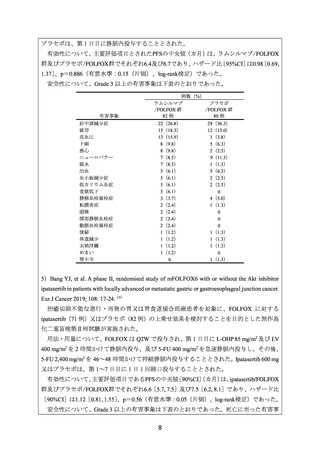
有効性について、主要評価項目とされた奏効率は、ECF 群、IC 群及び FOLFOX 群でそれ
ぞれ 60.3%(38/63 例)
、45.1%(32/71 例)及び 53.0%(35/66 例)であった。
安全性について、FOLFOX 群において発現率が 10%以上であった Grade 3 以上の主な有
害事象は、好中球減少症 31 例(43%)
、代謝障害 19 例(26%)
、皮膚障害及び胃腸障害各 16
例(22%)、白血球減少症、全身障害及び神経系障害各 12 例(16%)、貧血及び感染症各 5
例(7%)、血管障害 3 例(4%)
、血小板減少、リンパ球減少症及び疼痛各 2 例(3%)であ
った。FOLFOX 群における治療関連死として消化管出血 1 例が認められた。
FOLFOX への他の抗悪性腫瘍剤の上乗せ試験
3)Shah MA, et al.Effect of Fluorouracil, Leucovorin, and Oxaliplatin With or Without Onartuzumab
in HER2-Negative, MET-Positive Gastroesophageal Adenocarcinoma: The METGastric Randomized
Clinical Trial. JAMA Oncol 2017; 3: 620-7. 11)
HER2 陰性かつ間葉上皮転換因子(以下、
「MET」
)陽性の治癒切除不能な胃又は食道胃接
合部の腺癌患者を対象に、一次治療としての FOLFOX に対する onartuzumab(279 例)又は
プラセボ(283 例)の上乗せ(以下、それぞれ「onartuzumab/FOLFOX」及び「プラセボ
6
、悪心及び疲労各7例(8%)
、貧血6例(7%)
、下痢4例(4%)
、脱水2例(2%)で
あった。FOLFOX群における治療関連死として、肺感染、口腔粘膜炎及び原因不明の突然死
各1例が認められた。
2)Enzinger PC, et al. CALGB 80403 (Alliance)/E1206: A Randomized Phase II Study of Three
Chemotherapy Regimens Plus Cetuximab in Metastatic Esophageal and Gastroesophageal Junction
Cancers. J Clin Oncol 2016; 34: 2736-42. 5)
治癒切除不能な食道又は食道胃接合部癌患者を対象に、セツキシマブ(遺伝子組換え)
(以下、「セツキシマブ」
)の併用下で、一次治療としての ECF(エピルビシン、シスプラ
チン及び 5-FU の併用)
(82 例)
、IC(IRI とシスプラチンとの併用)
(83 例)又は FOLFOX
(80 例)の有効性及び安全性を比較することを目的とした無作為化第Ⅱ相試験が実施され
た。
用法・用量について、下表のとおり投与することとされた。
レジメン
ECF
IC
FOLFOX
薬剤名
エピルビシン
シスプラチン
5-FU
シスプラチン
IRI
LV
5-FU
5-FU
L-OHP
セツキシマブ
投与量(投与時間)
50 mg/m2
60 mg/m2
200 mg/m2
30 mg/m2
65 mg/m2
400 mg/m2
400 mg/m2(急速静注)
2,400 mg/m2(46~48 時間)
85 mg/m2
400 mg/m2
250 mg/m2
投与方法
Day1
Q3W
Day 1~21
Day1 及び 8
Q3W
Day1
Q2W
Day1
Day1
1 サイクル目のみ
週1回
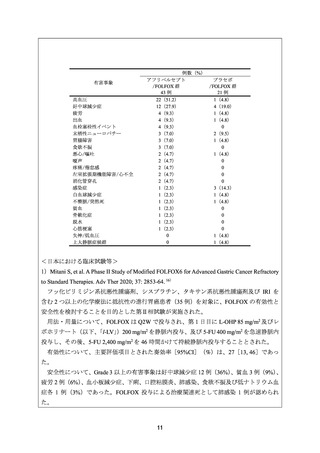
有効性について、主要評価項目とされた奏効率は、ECF 群、IC 群及び FOLFOX 群でそれ
ぞれ 60.3%(38/63 例)
、45.1%(32/71 例)及び 53.0%(35/66 例)であった。
安全性について、FOLFOX 群において発現率が 10%以上であった Grade 3 以上の主な有
害事象は、好中球減少症 31 例(43%)
、代謝障害 19 例(26%)
、皮膚障害及び胃腸障害各 16
例(22%)、白血球減少症、全身障害及び神経系障害各 12 例(16%)、貧血及び感染症各 5
例(7%)、血管障害 3 例(4%)
、血小板減少、リンパ球減少症及び疼痛各 2 例(3%)であ
った。FOLFOX 群における治療関連死として消化管出血 1 例が認められた。
FOLFOX への他の抗悪性腫瘍剤の上乗せ試験
3)Shah MA, et al.Effect of Fluorouracil, Leucovorin, and Oxaliplatin With or Without Onartuzumab
in HER2-Negative, MET-Positive Gastroesophageal Adenocarcinoma: The METGastric Randomized
Clinical Trial. JAMA Oncol 2017; 3: 620-7. 11)
HER2 陰性かつ間葉上皮転換因子(以下、
「MET」
)陽性の治癒切除不能な胃又は食道胃接
合部の腺癌患者を対象に、一次治療としての FOLFOX に対する onartuzumab(279 例)又は
プラセボ(283 例)の上乗せ(以下、それぞれ「onartuzumab/FOLFOX」及び「プラセボ
6