よむ、つかう、まなぶ。
資料4-3 レボホリナートカルシウム (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00024.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第52回 8/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
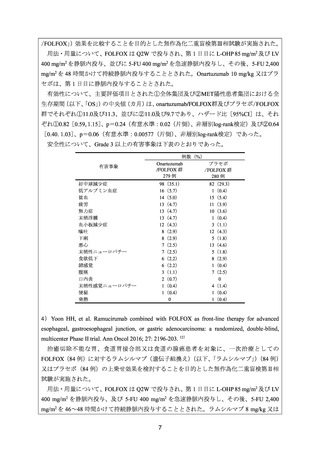
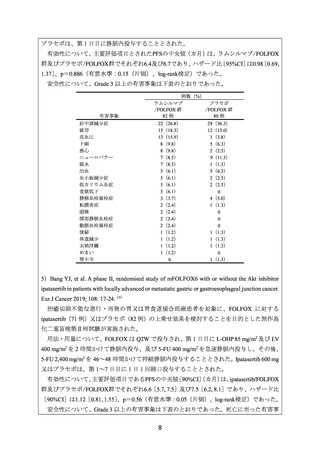
有効性について、PFS 及び OS の中央値は、それぞれ 7.5 及び 13.2 カ月であった。
安全性について、Grade 3 以上の有害事象は、好中球減少症、ALT 増加及び貧血各 3 例
(30%)、血小板減少症及び AST 増加各 2 例(20%)、白血球減少症、血中ビリルビン増
加及び末梢性ニューロパチー各 1 例(10%)であった。重篤な有害事象として、高血糖及び
細菌性肺炎各 1 例が認められた。
(2)Peer-reviewed journal の総説、メタ・アナリシス等の報告状況
1)Xu HB, et al. Capecitabine plus oxaliplatin (XELOX) compared with 5-fluorouracil/leucovorin
plus oxaliplatin (FOLFOXs) in advanced gastric cancer: meta-analysis of randomized controlled
trials. Eur J Clin Pharmacol 2015; 71: 589-601. 22)
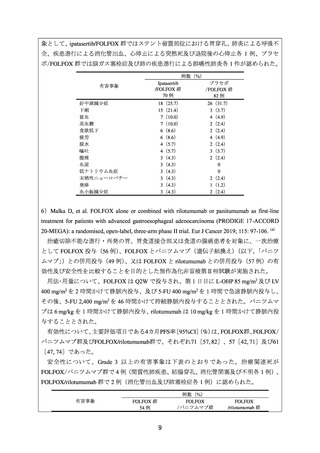
進行胃癌患者に対するカペシタビンと L-OHP との併用(以下、「CapeOX」)投与と
FOLFOX の有効性と安全性を比較することを目的としたメタ・アナリシスが実施された。
178 試験のうち 26 試験が解析対象とされた。
1,585 例(CapeOX:787 例、FOLFOX:798 例)が解析に含まれ、奏効率について CapeOX
と FOLFOX に統計学的な有意差は認められなかった(オッズ比[95%CI]は 1.18[1.00,
1.41]
、p=0.057)
。CapeOX と FOLFOX に共通して認められた主な毒性は白血球減少症、悪
心、末梢性感覚ニューロパチーであり、いずれの治療法においても約半数の患者に発現し
た。FOLFOX と比較して、CapeOX は、悪心、口内炎、下痢、脱毛の発現割合が低く、手足
症候群の発現割合が高かった。
2)Caponigro F, et al. Gastric cancer. Treatment of advanced disease and new drugs. Front Biosci.
2005; 10: 3122-6. 23)
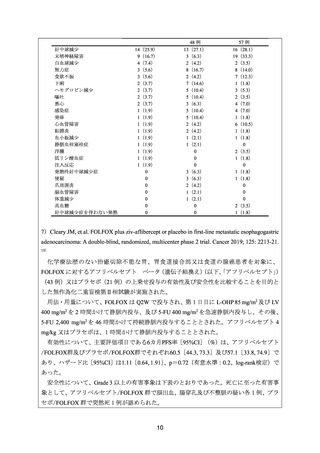
進行胃癌患者に対する FOLFOX 投与について、用法・用量が類似した 2 つの臨床試験 24)
及び 25)
にて一貫した臨床的有効性が示された旨が記載されている。
3)Scheithauer W, et al. The role of oxaliplatin in the management of upper gastrointestinal tract
malignancies. Colorectal Dis 2003; 5: 36-44. 26)
FOLFOX を検討した Artru らの結果
27)
より、FOLFOX は、5-FU とシスプラチンをベー
スとした化学療法と類似した有効性に加えて、より高い忍容性を有する旨が記載されてい
る。
4)Bécouarn Y, et al. Oxaliplatin: available data in non-colorectal gastrointestinal malignancies. Crit
Rev Oncol Hematol 2001; 40: 265-72. 28)
Louvet らの結果
24)
より、進行胃癌に対する FOLFOX は有効かつ忍容性の高い治療法で
ある旨が記載されている。
5)Shah MA. Update on Metastatic Gastric and Esophageal Cancers. J Clin Oncol 2015; 33: 1760-
14
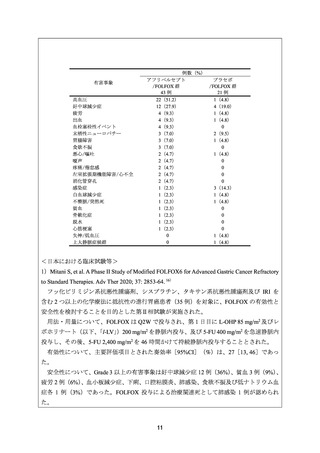
安全性について、Grade 3 以上の有害事象は、好中球減少症、ALT 増加及び貧血各 3 例
(30%)、血小板減少症及び AST 増加各 2 例(20%)、白血球減少症、血中ビリルビン増
加及び末梢性ニューロパチー各 1 例(10%)であった。重篤な有害事象として、高血糖及び
細菌性肺炎各 1 例が認められた。
(2)Peer-reviewed journal の総説、メタ・アナリシス等の報告状況
1)Xu HB, et al. Capecitabine plus oxaliplatin (XELOX) compared with 5-fluorouracil/leucovorin
plus oxaliplatin (FOLFOXs) in advanced gastric cancer: meta-analysis of randomized controlled
trials. Eur J Clin Pharmacol 2015; 71: 589-601. 22)
進行胃癌患者に対するカペシタビンと L-OHP との併用(以下、「CapeOX」)投与と
FOLFOX の有効性と安全性を比較することを目的としたメタ・アナリシスが実施された。
178 試験のうち 26 試験が解析対象とされた。
1,585 例(CapeOX:787 例、FOLFOX:798 例)が解析に含まれ、奏効率について CapeOX
と FOLFOX に統計学的な有意差は認められなかった(オッズ比[95%CI]は 1.18[1.00,
1.41]
、p=0.057)
。CapeOX と FOLFOX に共通して認められた主な毒性は白血球減少症、悪
心、末梢性感覚ニューロパチーであり、いずれの治療法においても約半数の患者に発現し
た。FOLFOX と比較して、CapeOX は、悪心、口内炎、下痢、脱毛の発現割合が低く、手足
症候群の発現割合が高かった。
2)Caponigro F, et al. Gastric cancer. Treatment of advanced disease and new drugs. Front Biosci.
2005; 10: 3122-6. 23)
進行胃癌患者に対する FOLFOX 投与について、用法・用量が類似した 2 つの臨床試験 24)
及び 25)
にて一貫した臨床的有効性が示された旨が記載されている。
3)Scheithauer W, et al. The role of oxaliplatin in the management of upper gastrointestinal tract
malignancies. Colorectal Dis 2003; 5: 36-44. 26)
FOLFOX を検討した Artru らの結果
27)
より、FOLFOX は、5-FU とシスプラチンをベー
スとした化学療法と類似した有効性に加えて、より高い忍容性を有する旨が記載されてい
る。
4)Bécouarn Y, et al. Oxaliplatin: available data in non-colorectal gastrointestinal malignancies. Crit
Rev Oncol Hematol 2001; 40: 265-72. 28)
Louvet らの結果
24)
より、進行胃癌に対する FOLFOX は有効かつ忍容性の高い治療法で
ある旨が記載されている。
5)Shah MA. Update on Metastatic Gastric and Esophageal Cancers. J Clin Oncol 2015; 33: 1760-
14