よむ、つかう、まなぶ。
資料4-2 フルオロウラシル (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00024.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第52回 8/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
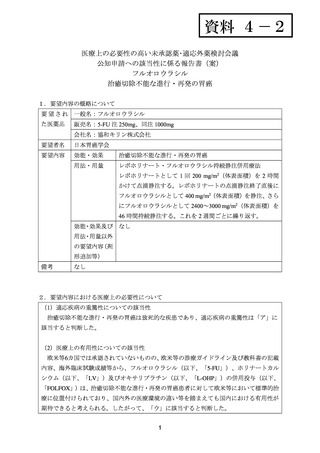
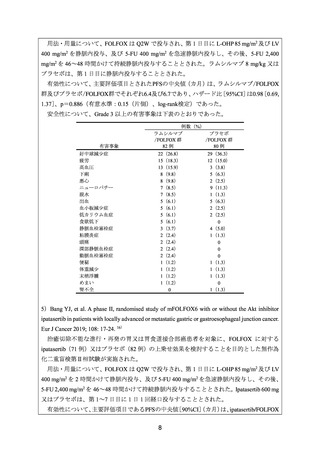
用法・用量について、FOLFOX は Q2W で投与され、第 1 日目に L-OHP 85 mg/m2 及び LV
400 mg/m2 を静脈内投与、及び 5-FU 400 mg/m2 を急速静脈内投与し、その後、5-FU 2,400
mg/m2 を 46~48 時間かけて持続静脈内投与することとされた。ラムシルマブ 8 mg/kg 又は
プラセボは、第 1 日目に静脈内投与することとされた。
有効性について、主要評価項目とされたPFSの中央値(カ月)は、ラムシルマブ/FOLFOX
群及びプラセボ/FOLFOX群でそれぞれ6.4及び6.7であり、ハザード比[95%CI]は0.98[0.69,
1.37]
、p=0.886(有意水準:0.15(片側)、log-rank検定)であった。
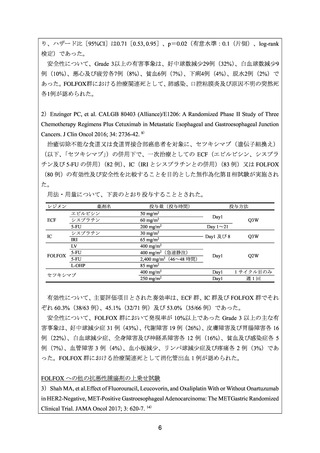
安全性について、Grade 3 以上の有害事象は下表のとおりであった。
有害事象
好中球減少症
疲労
高血圧
下痢
悪心
ニューロパチー
脱水
出血
血小板減少症
低カリウム血症
食欲低下
静脈血栓塞栓症
粘膜炎症
頭痛
深部静脈血栓症
動脈血栓塞栓症
便秘
体重減少
末梢浮腫
めまい
腎不全
例数(%)
ラムシルマブ
プラセボ
/FOLFOX 群
/FOLFOX 群
82 例
80 例
22(26.8)
15(18.3)
13(15.9)
8(9.8)
8(9.8)
7(8.5)
7(8.5)
5(6.1)
5(6.1)
5(6.1)
5(6.1)
3(3.7)
2(2.4)
2(2.4)
2(2.4)
2(2.4)
1(1.2)
1(1.2)
1(1.2)
1(1.2)
0
29(36.3)
12(15.0)
3(3.8)
5(6.3)
2(2.5)
9(11.3)
1(1.3)
5(6.3)
2(2.5)
2(2.5)
0
4(5.0)
1(1.3)
0
0
0
1(1.3)
1(1.3)
1(1.3)
0
1(1.3)
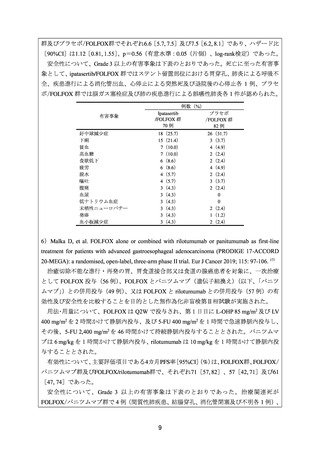
5)Bang YJ, et al. A phase II, randomised study of mFOLFOX6 with or without the Akt inhibitor
ipatasertib in patients with locally advanced or metastatic gastric or gastroesophageal junction cancer.
Eur J Cancer 2019; 108: 17-24. 16)
治癒切除不能な進行・再発の胃又は胃食道接合部癌患者を対象に、FOLFOX に対する
ipatasertib(71 例)又はプラセボ(82 例)の上乗せ効果を検討することを目的とした無作為
化二重盲検第Ⅱ相試験が実施された。
用法・用量について、FOLFOX は Q2W で投与され、第 1 日目に L-OHP 85 mg/m2 及び LV
400 mg/m2 を 2 時間かけて静脈内投与、及び 5-FU 400 mg/m2 を急速静脈内投与し、その後、
5-FU 2,400 mg/m2 を 46~48 時間かけて持続静脈内投与することとされた。Ipatasertib 600 mg
又はプラセボは、第 1~7 日目に 1 日 1 回経口投与することとされた。
有効性について、主要評価項目であるPFSの中央値[90%CI]
(カ月)は、ipatasertib/FOLFOX
8
400 mg/m2 を静脈内投与、及び 5-FU 400 mg/m2 を急速静脈内投与し、その後、5-FU 2,400
mg/m2 を 46~48 時間かけて持続静脈内投与することとされた。ラムシルマブ 8 mg/kg 又は
プラセボは、第 1 日目に静脈内投与することとされた。
有効性について、主要評価項目とされたPFSの中央値(カ月)は、ラムシルマブ/FOLFOX
群及びプラセボ/FOLFOX群でそれぞれ6.4及び6.7であり、ハザード比[95%CI]は0.98[0.69,
1.37]
、p=0.886(有意水準:0.15(片側)、log-rank検定)であった。
安全性について、Grade 3 以上の有害事象は下表のとおりであった。
有害事象
好中球減少症
疲労
高血圧
下痢
悪心
ニューロパチー
脱水
出血
血小板減少症
低カリウム血症
食欲低下
静脈血栓塞栓症
粘膜炎症
頭痛
深部静脈血栓症
動脈血栓塞栓症
便秘
体重減少
末梢浮腫
めまい
腎不全
例数(%)
ラムシルマブ
プラセボ
/FOLFOX 群
/FOLFOX 群
82 例
80 例
22(26.8)
15(18.3)
13(15.9)
8(9.8)
8(9.8)
7(8.5)
7(8.5)
5(6.1)
5(6.1)
5(6.1)
5(6.1)
3(3.7)
2(2.4)
2(2.4)
2(2.4)
2(2.4)
1(1.2)
1(1.2)
1(1.2)
1(1.2)
0
29(36.3)
12(15.0)
3(3.8)
5(6.3)
2(2.5)
9(11.3)
1(1.3)
5(6.3)
2(2.5)
2(2.5)
0
4(5.0)
1(1.3)
0
0
0
1(1.3)
1(1.3)
1(1.3)
0
1(1.3)
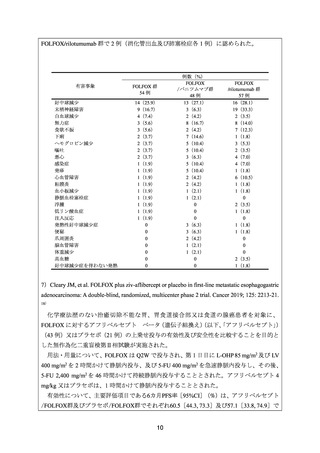
5)Bang YJ, et al. A phase II, randomised study of mFOLFOX6 with or without the Akt inhibitor
ipatasertib in patients with locally advanced or metastatic gastric or gastroesophageal junction cancer.
Eur J Cancer 2019; 108: 17-24. 16)
治癒切除不能な進行・再発の胃又は胃食道接合部癌患者を対象に、FOLFOX に対する
ipatasertib(71 例)又はプラセボ(82 例)の上乗せ効果を検討することを目的とした無作為
化二重盲検第Ⅱ相試験が実施された。
用法・用量について、FOLFOX は Q2W で投与され、第 1 日目に L-OHP 85 mg/m2 及び LV
400 mg/m2 を 2 時間かけて静脈内投与、及び 5-FU 400 mg/m2 を急速静脈内投与し、その後、
5-FU 2,400 mg/m2 を 46~48 時間かけて持続静脈内投与することとされた。Ipatasertib 600 mg
又はプラセボは、第 1~7 日目に 1 日 1 回経口投与することとされた。
有効性について、主要評価項目であるPFSの中央値[90%CI]
(カ月)は、ipatasertib/FOLFOX
8