よむ、つかう、まなぶ。
資料4-2 フルオロウラシル (7 ページ)
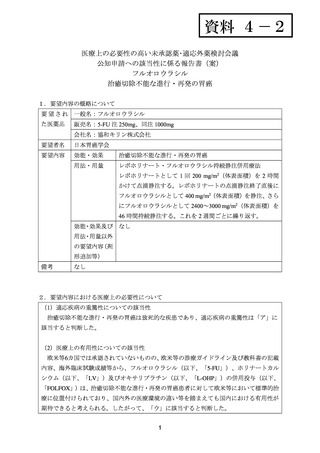
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00024.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第52回 8/31)《厚生労働省》 |
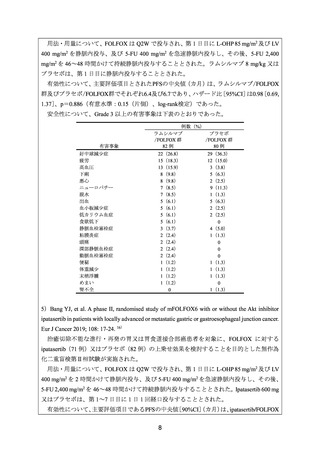
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
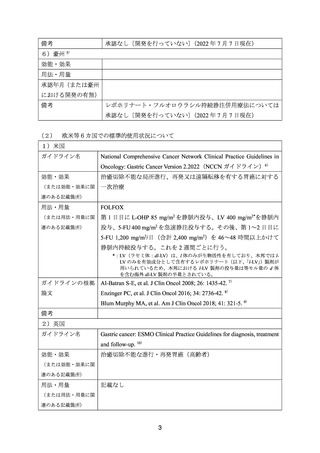
HER2 陰性かつ間葉上皮転換因子(以下、
「MET」
)陽性の治癒切除不能な胃又は食道胃接
合部の腺癌患者を対象に、一次治療としての FOLFOX に対する onartuzumab(279 例)又は
プラセボ(283 例)の上乗せ(以下、それぞれ「onartuzumab/FOLFOX」及び「プラセボ
/FOLFOX」
)効果を比較することを目的とした無作為化二重盲検第Ⅲ相試験が実施された。
用法・用量について、FOLFOX は Q2W で投与され、第 1 日目に L-OHP 85 mg/m2 及び LV
400 mg/m2 を静脈内投与、並びに 5-FU 400 mg/m2 を急速静脈内投与し、その後、5-FU 2,400
mg/m2 を 48 時間かけて持続静脈内投与することとされた。Onartuzumab 10 mg/kg 又はプラ
セボは、第 1 日目に静脈内投与することとされた。
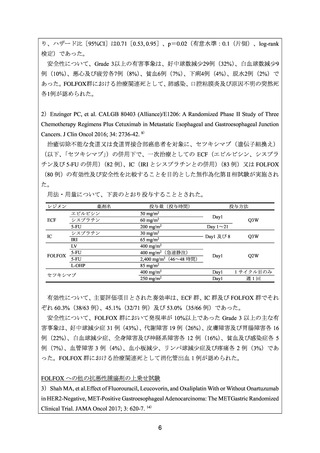
有効性について、主要評価項目とされた①全体集団及び②MET陽性患者集団における全
生存期間(以下、
「OS」
)の中央値(カ月)は、onartuzumab/FOLFOX群及びプラセボ/FOLFOX
群でそれぞれ①11.0及び11.3、並びに②11.0及び9.7であり、ハザード比[95%CI]は、それ
ぞれ①0.82[0.59, 1.15]
、p=0.24(有意水準:0.02(片側)
、非層別log-rank検定)及び②0.64
[0.40. 1.03]、p=0.06(有意水準:0.00577(片側)、非層別log-rank検定)であった。
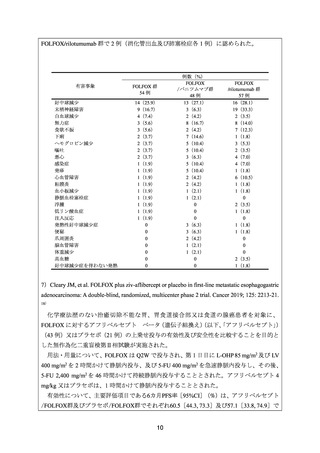
安全性について、Grade 3 以上の有害事象は下表のとおりであった。
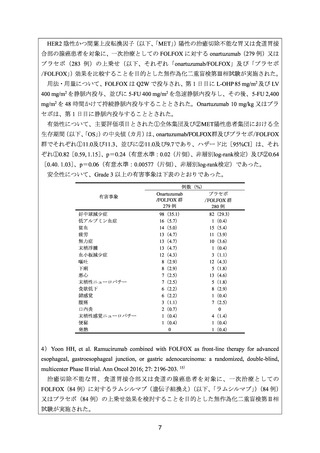
有害事象
好中球減少症
低アルブミン血症
貧血
疲労
無力症
末梢浮腫
血小板減少症
嘔吐
下痢
悪心
末梢性ニューロパチー
食欲低下
錯感覚
腹痛
口内炎
末梢性感覚ニューロパチー
便秘
発熱
例数(%)
Onartuzumab
プラセボ
/FOLFOX 群
/FOLFOX 群
279 例
280 例
98(35.1)
16(5.7)
14(5.0)
13(4.7)
13(4.7)
13(4.7)
12(4.3)
8(2.9)
8(2.9)
7(2.5)
7(2.5)
6(2.2)
6(2.2)
3(1.1)
2(0.7)
1(0.4)
1(0.4)
0
82(29.3)
1(0.4)
15(5.4)
11(3.9)
10(3.6)
1(0.4)
3(1.1)
12(4.3)
5(1.8)
13(4.6)
5(1.8)
8(2.9)
1(0.4)
7(2.5)
0
4(1.4)
1(0.4)
1(0.4)
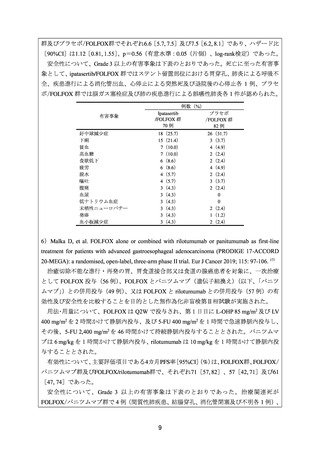
4)Yoon HH, et al. Ramucirumab combined with FOLFOX as front-line therapy for advanced
esophageal, gastroesophageal junction, or gastric adenocarcinoma: a randomized, double-blind,
multicenter Phase II trial. Ann Oncol 2016; 27: 2196-203. 15)
治癒切除不能な胃、食道胃接合部又は食道の腺癌患者を対象に、一次治療としての
FOLFOX(84 例)に対するラムシルマブ(遺伝子組換え)
(以下、
「ラムシルマブ」)
(84 例)
又はプラセボ(84 例)の上乗せ効果を検討することを目的とした無作為化二重盲検第Ⅱ相
試験が実施された。
7
「MET」
)陽性の治癒切除不能な胃又は食道胃接
合部の腺癌患者を対象に、一次治療としての FOLFOX に対する onartuzumab(279 例)又は
プラセボ(283 例)の上乗せ(以下、それぞれ「onartuzumab/FOLFOX」及び「プラセボ
/FOLFOX」
)効果を比較することを目的とした無作為化二重盲検第Ⅲ相試験が実施された。
用法・用量について、FOLFOX は Q2W で投与され、第 1 日目に L-OHP 85 mg/m2 及び LV
400 mg/m2 を静脈内投与、並びに 5-FU 400 mg/m2 を急速静脈内投与し、その後、5-FU 2,400
mg/m2 を 48 時間かけて持続静脈内投与することとされた。Onartuzumab 10 mg/kg 又はプラ
セボは、第 1 日目に静脈内投与することとされた。
有効性について、主要評価項目とされた①全体集団及び②MET陽性患者集団における全
生存期間(以下、
「OS」
)の中央値(カ月)は、onartuzumab/FOLFOX群及びプラセボ/FOLFOX
群でそれぞれ①11.0及び11.3、並びに②11.0及び9.7であり、ハザード比[95%CI]は、それ
ぞれ①0.82[0.59, 1.15]
、p=0.24(有意水準:0.02(片側)
、非層別log-rank検定)及び②0.64
[0.40. 1.03]、p=0.06(有意水準:0.00577(片側)、非層別log-rank検定)であった。
安全性について、Grade 3 以上の有害事象は下表のとおりであった。
有害事象
好中球減少症
低アルブミン血症
貧血
疲労
無力症
末梢浮腫
血小板減少症
嘔吐
下痢
悪心
末梢性ニューロパチー
食欲低下
錯感覚
腹痛
口内炎
末梢性感覚ニューロパチー
便秘
発熱
例数(%)
Onartuzumab
プラセボ
/FOLFOX 群
/FOLFOX 群
279 例
280 例
98(35.1)
16(5.7)
14(5.0)
13(4.7)
13(4.7)
13(4.7)
12(4.3)
8(2.9)
8(2.9)
7(2.5)
7(2.5)
6(2.2)
6(2.2)
3(1.1)
2(0.7)
1(0.4)
1(0.4)
0
82(29.3)
1(0.4)
15(5.4)
11(3.9)
10(3.6)
1(0.4)
3(1.1)
12(4.3)
5(1.8)
13(4.6)
5(1.8)
8(2.9)
1(0.4)
7(2.5)
0
4(1.4)
1(0.4)
1(0.4)
4)Yoon HH, et al. Ramucirumab combined with FOLFOX as front-line therapy for advanced
esophageal, gastroesophageal junction, or gastric adenocarcinoma: a randomized, double-blind,
multicenter Phase II trial. Ann Oncol 2016; 27: 2196-203. 15)
治癒切除不能な胃、食道胃接合部又は食道の腺癌患者を対象に、一次治療としての
FOLFOX(84 例)に対するラムシルマブ(遺伝子組換え)
(以下、
「ラムシルマブ」)
(84 例)
又はプラセボ(84 例)の上乗せ効果を検討することを目的とした無作為化二重盲検第Ⅱ相
試験が実施された。
7