よむ、つかう、まなぶ。
資 料2-1 血液製剤に関する医療機関からの感染症報告事例等について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26025.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第1回 6/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
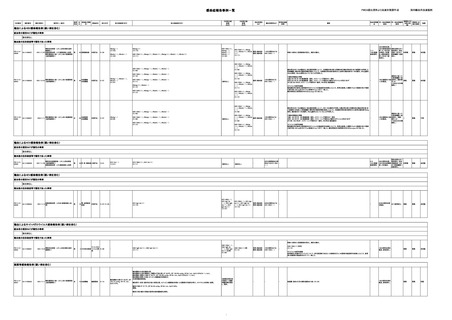
感染症報告事例一覧
識別番号
報告受領日
販売名(一般名)
患者
原疾患(簡
年代
感染症名
性別
略名)
投与年月
投与前検査(年月)
投与後検査(年月)
PMDA提出資料より血液対策課作成
患者 受血者
原料血漿・製品NAT検査(再検査・製 併用血液製
検体 個別
造時検査の別)
剤等
確保 NAT
備考
ロット番号
同一製剤ロット使用状況
国内血漿分画製剤
重篤性(担
重篤性(企
当医の見
業の見解)
解)
転帰
AA-21000035
2021/11/9
コンコエイト-HT(乾燥濃縮人血液凝
固第8因子)
男
40 血液疾患
HIV感染
C型肝炎
-
-
血友病Aによる非加熱の血液凝固因子製剤によりHIV、HCVに罹患した。
-
-
-
投与された非加熱の血液凝固因子製剤は過去の血液凝固因子製剤であると考えられ、
入手不可
現在の製剤による感染症報告ではない。
-
ー
重篤
未回復
未回復
AA-21000036
2021/11/19
クリスマシンM(乾燥濃縮人血液凝固
第9因子)
男
40 血液疾患
HIV感染
慢性C型
肝炎
-
-
血友病Bによる血液製剤により慢性C型肝炎、HIVに罹患した。
-
-
-
投与された血液製剤は過去の血液製剤(第IX因子製剤)であると考えられ、現在の製剤による
入手不可
感染症報告ではない。
-
ー
重篤
未回復
未回復
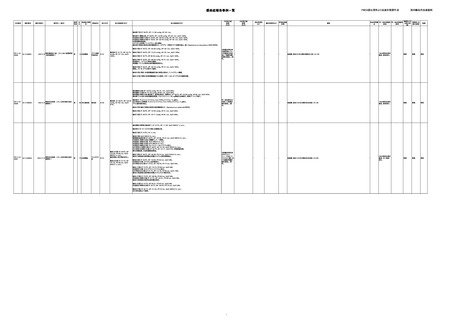
AA-21000040
コンコエイト-HT(乾燥濃縮人血液凝
固第8因子)
2021/11/30
クリスマシンM(乾燥濃縮人血液凝固
第9因子)
男
HIV感染
-
-
血液製剤によりHIVに罹患した。
-
-
-
投与された血液製剤は過去の血液凝固因子製剤であると考えられ、現在の製剤による
感染症報告ではない。
入手不可
入手不可
-
ー
重篤
未回復
コンコエイト-HT(乾燥濃縮人血液凝
固第8因子)
男
C型肝炎
HIV感染
-
-
献血由来の凝固因子製剤によりC型肝炎、HIVに罹患した。
-
-
-
投与された血液凝固因子製剤は過去の血液凝固因子製剤であると考えられ、現在の製
入手不可
剤による感染症報告ではない。
-
ー
重篤
未回復
未回復
AA-21000042
AA-21000044
2021/12/8
2021/12/24 アルブミナー(人血清アルブミン)
男
--
40 血液疾患
B型肝炎
B型肝炎
表面抗体
B型肝炎e
循環器疾患 抗原陽性
60
02/09
循環器疾患 B型肝炎e
抗体陽性
B型肝炎
コア抗体
陽性
1.当該製品のウイルス安全性につい
て
当該製品に使用されている原料血漿
は、各種ウイルス検査が陰性である登
録されたドナーから採取されている。 原
料血漿供給元である採血センターで
は、供血者毎に血清学的検査により
HBs抗原が陰性であることを確認してい
る。 ミニプール血漿及び製造プール血
漿においては、NATによりHBVが陰性
であることを確認している。
HBs抗体/PHA:8以下、HBe抗原 RIA法:+(カットオフインデックス6.0)、
HBs抗原:RPHA<
HBe抗体/RIA:+-(阻害率67.7%)
8、 HBs抗体:PHA
HBc抗体/CLIA:+(S/CO:7.79)、HBc抗体 IgM:+(カットオフインデックス7.2)
<8、HCV(-)
HA抗体/EIA:-、HA抗体 IgM/EIA:-
(02/09)
(03/04)
-
-
2.製造工程中でのウイルス除去・不活
化
当該製品の製造工程中には、60℃、10
時間液状加熱処理(パスツリゼーショ
ン)等のウイルス除去・不活化工程が組
み込まれている。また、製造工程にお
けるウイルス除去・不活化を確認する
ために、モデルウイルスを用いたウイル
スバリデーション試験を行い、「血漿分
画製剤のウイルス安全対策について」
(平成15年11月7日付 厚生労働省医薬
食品局 4課長連名通知 第1107001号)
において、ウイルスが十分に除去・不活
化されていると判断されたウイルスクリ
アランス指数9以上が得られることを確
認している。
人血小板濃
厚液(人血
小板濃厚
液)
濃厚赤血球
(人赤血球
液)
新鮮凍結血
漿(新鮮凍
結人血漿)
ボルヒール
(フィブリノ
ゲン加第13
因子(3))
2D017C
-
ー
重篤
不明
不明
不明
不明
不明
unknown
-
ー
重篤
不明
unknown
-
ー
重篤
回復
1.当該製品のウイルス安全性につい
て
当該製品に使用されている原料血漿
は、各種ウイルス検査が陰性である登
録されたドナーから採取されている。 原
料血漿供給元である採血センターで
は、供血者毎に血清学的検査により
HBs抗原が陰性であることを確認してい
る。 ミニプール血漿及び製造プール血
漿においては、NATによりHBVが陰性
であることを確認している。
AA-21000045
フィブロガミンP(ヒト血漿由来乾燥血
2021/12/24
液凝固第13因子 )
男
肝・胆・膵
検査結果
60 疾患
03/04
偽陽性
消化器腫瘍
-
本剤投与後6ヶ月にC型肝炎検査結果が陽性となった。
-
-
2.製造工程中でのウイルス除去・不活
化
当該製品の製造工程中には、60℃、10
時間液状加熱処理(パスツリゼーショ
ン)等のウイルス除去・不活化工程が組
み込まれている。また、製造工程にお
けるウイルス除去・不活化を確認する
ために、モデルウイルスを用いたウイル
スバリデーション試験を行い、「血漿分
画製剤のウイルス安全対策について」
(平成15年11月7日付 厚生労働省医薬
食品局 4課長連名通知 第1107001号)
において、ウイルスが十分に除去・不活
化されていると判断されたウイルスクリ
アランス指数10以上が得られることを
確認している。
Alb 2.5 g/dL と低値であった為、本剤250 mL/日 開始した。
AA-21000050
2022/1/25 アルブミナー(人血清アルブミン )
男
60 -
セラチア性
03/10
敗血症
投与開始8日~12
日前 直腸癌にて、
放射線治療。
低位前方切除施
行。
順調に経過してい
た。
投与開始4日目 投与直後より、悪寒と38.4℃の発熱出現。
投与開始2時間30分後 HR 128 /min と増加。直ちに投与を中止。40℃まで発熱。
血液培養検査実施。血液データより敗血症とそれによる溶血反応が疑われた。重
症感染症として、ヒドロコルチゾンコハク酸エステルナトリウム投与。メロペネム水和
物投与。
-
投与開始5日目 その後、全身状態、データとも翌日より徐々に落着いていった。
患者血液培養検査より、Serratia marcescens を同定。
6
適用バイアルに残存する本剤の無菌試
験は陰性であった。
識別番号
報告受領日
販売名(一般名)
患者
原疾患(簡
年代
感染症名
性別
略名)
投与年月
投与前検査(年月)
投与後検査(年月)
PMDA提出資料より血液対策課作成
患者 受血者
原料血漿・製品NAT検査(再検査・製 併用血液製
検体 個別
造時検査の別)
剤等
確保 NAT
備考
ロット番号
同一製剤ロット使用状況
国内血漿分画製剤
重篤性(担
重篤性(企
当医の見
業の見解)
解)
転帰
AA-21000035
2021/11/9
コンコエイト-HT(乾燥濃縮人血液凝
固第8因子)
男
40 血液疾患
HIV感染
C型肝炎
-
-
血友病Aによる非加熱の血液凝固因子製剤によりHIV、HCVに罹患した。
-
-
-
投与された非加熱の血液凝固因子製剤は過去の血液凝固因子製剤であると考えられ、
入手不可
現在の製剤による感染症報告ではない。
-
ー
重篤
未回復
未回復
AA-21000036
2021/11/19
クリスマシンM(乾燥濃縮人血液凝固
第9因子)
男
40 血液疾患
HIV感染
慢性C型
肝炎
-
-
血友病Bによる血液製剤により慢性C型肝炎、HIVに罹患した。
-
-
-
投与された血液製剤は過去の血液製剤(第IX因子製剤)であると考えられ、現在の製剤による
入手不可
感染症報告ではない。
-
ー
重篤
未回復
未回復
AA-21000040
コンコエイト-HT(乾燥濃縮人血液凝
固第8因子)
2021/11/30
クリスマシンM(乾燥濃縮人血液凝固
第9因子)
男
HIV感染
-
-
血液製剤によりHIVに罹患した。
-
-
-
投与された血液製剤は過去の血液凝固因子製剤であると考えられ、現在の製剤による
感染症報告ではない。
入手不可
入手不可
-
ー
重篤
未回復
コンコエイト-HT(乾燥濃縮人血液凝
固第8因子)
男
C型肝炎
HIV感染
-
-
献血由来の凝固因子製剤によりC型肝炎、HIVに罹患した。
-
-
-
投与された血液凝固因子製剤は過去の血液凝固因子製剤であると考えられ、現在の製
入手不可
剤による感染症報告ではない。
-
ー
重篤
未回復
未回復
AA-21000042
AA-21000044
2021/12/8
2021/12/24 アルブミナー(人血清アルブミン)
男
--
40 血液疾患
B型肝炎
B型肝炎
表面抗体
B型肝炎e
循環器疾患 抗原陽性
60
02/09
循環器疾患 B型肝炎e
抗体陽性
B型肝炎
コア抗体
陽性
1.当該製品のウイルス安全性につい
て
当該製品に使用されている原料血漿
は、各種ウイルス検査が陰性である登
録されたドナーから採取されている。 原
料血漿供給元である採血センターで
は、供血者毎に血清学的検査により
HBs抗原が陰性であることを確認してい
る。 ミニプール血漿及び製造プール血
漿においては、NATによりHBVが陰性
であることを確認している。
HBs抗体/PHA:8以下、HBe抗原 RIA法:+(カットオフインデックス6.0)、
HBs抗原:RPHA<
HBe抗体/RIA:+-(阻害率67.7%)
8、 HBs抗体:PHA
HBc抗体/CLIA:+(S/CO:7.79)、HBc抗体 IgM:+(カットオフインデックス7.2)
<8、HCV(-)
HA抗体/EIA:-、HA抗体 IgM/EIA:-
(02/09)
(03/04)
-
-
2.製造工程中でのウイルス除去・不活
化
当該製品の製造工程中には、60℃、10
時間液状加熱処理(パスツリゼーショ
ン)等のウイルス除去・不活化工程が組
み込まれている。また、製造工程にお
けるウイルス除去・不活化を確認する
ために、モデルウイルスを用いたウイル
スバリデーション試験を行い、「血漿分
画製剤のウイルス安全対策について」
(平成15年11月7日付 厚生労働省医薬
食品局 4課長連名通知 第1107001号)
において、ウイルスが十分に除去・不活
化されていると判断されたウイルスクリ
アランス指数9以上が得られることを確
認している。
人血小板濃
厚液(人血
小板濃厚
液)
濃厚赤血球
(人赤血球
液)
新鮮凍結血
漿(新鮮凍
結人血漿)
ボルヒール
(フィブリノ
ゲン加第13
因子(3))
2D017C
-
ー
重篤
不明
不明
不明
不明
不明
unknown
-
ー
重篤
不明
unknown
-
ー
重篤
回復
1.当該製品のウイルス安全性につい
て
当該製品に使用されている原料血漿
は、各種ウイルス検査が陰性である登
録されたドナーから採取されている。 原
料血漿供給元である採血センターで
は、供血者毎に血清学的検査により
HBs抗原が陰性であることを確認してい
る。 ミニプール血漿及び製造プール血
漿においては、NATによりHBVが陰性
であることを確認している。
AA-21000045
フィブロガミンP(ヒト血漿由来乾燥血
2021/12/24
液凝固第13因子 )
男
肝・胆・膵
検査結果
60 疾患
03/04
偽陽性
消化器腫瘍
-
本剤投与後6ヶ月にC型肝炎検査結果が陽性となった。
-
-
2.製造工程中でのウイルス除去・不活
化
当該製品の製造工程中には、60℃、10
時間液状加熱処理(パスツリゼーショ
ン)等のウイルス除去・不活化工程が組
み込まれている。また、製造工程にお
けるウイルス除去・不活化を確認する
ために、モデルウイルスを用いたウイル
スバリデーション試験を行い、「血漿分
画製剤のウイルス安全対策について」
(平成15年11月7日付 厚生労働省医薬
食品局 4課長連名通知 第1107001号)
において、ウイルスが十分に除去・不活
化されていると判断されたウイルスクリ
アランス指数10以上が得られることを
確認している。
Alb 2.5 g/dL と低値であった為、本剤250 mL/日 開始した。
AA-21000050
2022/1/25 アルブミナー(人血清アルブミン )
男
60 -
セラチア性
03/10
敗血症
投与開始8日~12
日前 直腸癌にて、
放射線治療。
低位前方切除施
行。
順調に経過してい
た。
投与開始4日目 投与直後より、悪寒と38.4℃の発熱出現。
投与開始2時間30分後 HR 128 /min と増加。直ちに投与を中止。40℃まで発熱。
血液培養検査実施。血液データより敗血症とそれによる溶血反応が疑われた。重
症感染症として、ヒドロコルチゾンコハク酸エステルナトリウム投与。メロペネム水和
物投与。
-
投与開始5日目 その後、全身状態、データとも翌日より徐々に落着いていった。
患者血液培養検査より、Serratia marcescens を同定。
6
適用バイアルに残存する本剤の無菌試
験は陰性であった。