よむ、つかう、まなぶ。
総-3参考4 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_67369.html |
| 出典情報 | 中央社会保険医療協議会 総会(第636回 12/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3.臨床成績
切除不能な肝細胞癌の承認時に評価を行った主な臨床試験の成績を示す。
【有効性】
国際共同第 III 相試験(IMbrave150 試験)
全身化学療法歴のない Child-Pugh 分類 A の切除不能な肝細胞癌患者*1501 例(日本人
61 例を含む)を対象に、本剤及びベバシズマブ(遺伝子組換え)
(以下、
「ベバシズマブ」
という。)の併用投与(本剤併用群、336 例)の有効性及び安全性をソラフェニブトシル
酸塩(以下、
「ソラフェニブ」という。)
(ソラフェニブ群、165 例)と比較する第 III 相
試験を実施した*2。
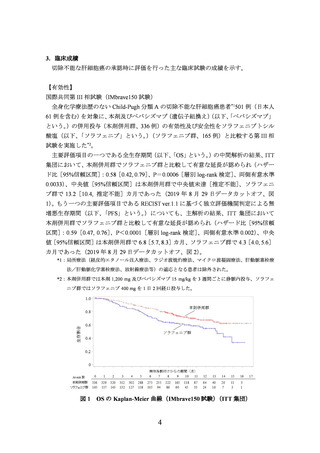
主要評価項目の一つである全生存期間(以下、
「OS」という。)の中間解析の結果、ITT
集団において、本剤併用群でソラフェニブ群と比較して有意な延長が認められ(ハザー
ド比[95%信頼区間]
:0.58[0.42, 0.79]
、P=0.0006[層別 log-rank 検定]、両側有意水準
0.0033)、中央値[95%信頼区間]は本剤併用群で中央値未達[推定不能]
、ソラフェニ
ブ群で 13.2[10.4, 推定不能]カ月であった(2019 年 8 月 29 日データカットオフ、図
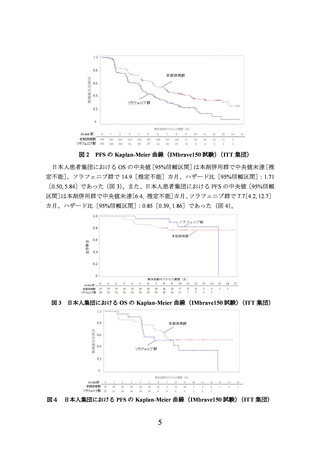
1)。もう一つの主要評価項目である RECIST ver.1.1 に基づく独立評価機関判定による無
増悪生存期間(以下、
「PFS」という。
)についても、主解析の結果、ITT 集団において
本剤併用群でソラフェニブ群と比較して有意な延長が認められ(ハザード比[95%信頼
区間]:0.59[0.47, 0.76]
、P<0.0001[層別 log-rank 検定]、両側有意水準 0.002)、中央
値[95%信頼区間]は本剤併用群で 6.8[5.7, 8.3]カ月、ソラフェニブ群で 4.3[4.0, 5.6]
カ月であった(2019 年 8 月 29 日データカットオフ、図 2)
。
*1:局所療法(経皮的エタノール注入療法、ラジオ波焼灼療法、マイクロ波凝固療法、肝動脈塞栓療
法/肝動脈化学塞栓療法、放射線療法等)の適応となる患者は除外された。
*2:本剤併用群では本剤 1,200 mg 及びベバシズマブ 15 mg/kg を 3 週間ごとに静脈内投与、ソラフェ
ニブ群ではソラフェニブ 400 mg を 1 日 2 回経口投与した。
図 1 OS の Kaplan-Meier 曲線(IMbrave150 試験)
(ITT 集団)
4
切除不能な肝細胞癌の承認時に評価を行った主な臨床試験の成績を示す。
【有効性】
国際共同第 III 相試験(IMbrave150 試験)
全身化学療法歴のない Child-Pugh 分類 A の切除不能な肝細胞癌患者*1501 例(日本人
61 例を含む)を対象に、本剤及びベバシズマブ(遺伝子組換え)
(以下、
「ベバシズマブ」
という。)の併用投与(本剤併用群、336 例)の有効性及び安全性をソラフェニブトシル
酸塩(以下、
「ソラフェニブ」という。)
(ソラフェニブ群、165 例)と比較する第 III 相
試験を実施した*2。
主要評価項目の一つである全生存期間(以下、
「OS」という。)の中間解析の結果、ITT
集団において、本剤併用群でソラフェニブ群と比較して有意な延長が認められ(ハザー
ド比[95%信頼区間]
:0.58[0.42, 0.79]
、P=0.0006[層別 log-rank 検定]、両側有意水準
0.0033)、中央値[95%信頼区間]は本剤併用群で中央値未達[推定不能]
、ソラフェニ
ブ群で 13.2[10.4, 推定不能]カ月であった(2019 年 8 月 29 日データカットオフ、図
1)。もう一つの主要評価項目である RECIST ver.1.1 に基づく独立評価機関判定による無
増悪生存期間(以下、
「PFS」という。
)についても、主解析の結果、ITT 集団において
本剤併用群でソラフェニブ群と比較して有意な延長が認められ(ハザード比[95%信頼
区間]:0.59[0.47, 0.76]
、P<0.0001[層別 log-rank 検定]、両側有意水準 0.002)、中央
値[95%信頼区間]は本剤併用群で 6.8[5.7, 8.3]カ月、ソラフェニブ群で 4.3[4.0, 5.6]
カ月であった(2019 年 8 月 29 日データカットオフ、図 2)
。
*1:局所療法(経皮的エタノール注入療法、ラジオ波焼灼療法、マイクロ波凝固療法、肝動脈塞栓療
法/肝動脈化学塞栓療法、放射線療法等)の適応となる患者は除外された。
*2:本剤併用群では本剤 1,200 mg 及びベバシズマブ 15 mg/kg を 3 週間ごとに静脈内投与、ソラフェ
ニブ群ではソラフェニブ 400 mg を 1 日 2 回経口投与した。
図 1 OS の Kaplan-Meier 曲線(IMbrave150 試験)
(ITT 集団)
4