よむ、つかう、まなぶ。
資料10 特定用途医薬品の運用変更について[3.5MB] (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
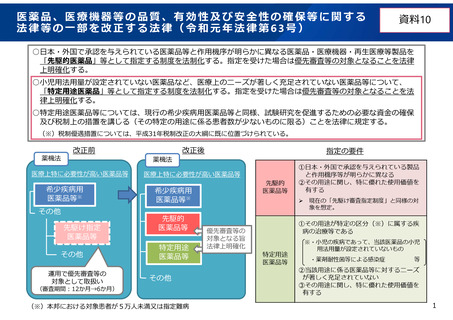
小児用医薬品のドラッグロス解消に向けた制度的対応
対応の方向性
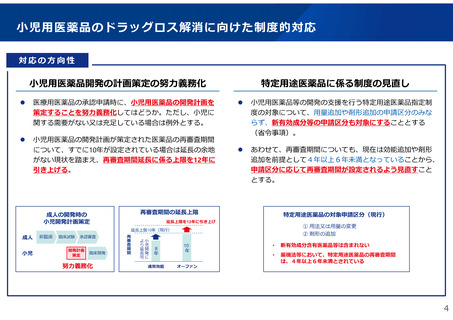
小児用医薬品開発の計画策定の努力義務化
医療用医薬品の承認申請時に、小児用医薬品の開発計画を
策定することを努力義務化してはどうか。ただし、小児に
関する需要がない又は充足している場合は例外とする。
小児用医薬品の開発計画が策定された医薬品の再審査期間
について、すでに10年が設定されている場合は延長の余地
がない現状を踏まえ、再審査期間延長に係る上限を12年に
引き上げる。
特定用途医薬品に係る制度の見直し
小児用医薬品等の開発の支援を行う特定用途医薬品指定制
度の対象について、用量追加や剤形追加の申請区分のみな
らず、新有効成分等の申請区分も対象にすることとする
(省令事項)。
あわせて、再審査期間についても、現在は効能追加や剤形
追加を前提として4年以上6年未満となっていることから、
申請区分に応じて再審査期間が設定されるよう見直すこと
とする。
再審査期間の延長上限
成人の開発時の
小児開発計画策定
特定用途医薬品の対象申請区分(現行)
延長上限を12年に引き上げ
① 用法又は用量の変更
② 剤形の追加
臨床試験
承認審査
臨床開発
努力義務化
通常効能
10
年
開発計画
策定
8年
小児
非臨床
小児開発に
より延長可
成人
再審査期間
延長上限10年(現行)
オーファン
•
新有効成分含有医薬品等は含まれない
•
薬機法等において、特定用途医薬品の再審査期間
は、4年以上6年未満とされている
4
対応の方向性
小児用医薬品開発の計画策定の努力義務化
医療用医薬品の承認申請時に、小児用医薬品の開発計画を
策定することを努力義務化してはどうか。ただし、小児に
関する需要がない又は充足している場合は例外とする。
小児用医薬品の開発計画が策定された医薬品の再審査期間
について、すでに10年が設定されている場合は延長の余地
がない現状を踏まえ、再審査期間延長に係る上限を12年に
引き上げる。
特定用途医薬品に係る制度の見直し
小児用医薬品等の開発の支援を行う特定用途医薬品指定制
度の対象について、用量追加や剤形追加の申請区分のみな
らず、新有効成分等の申請区分も対象にすることとする
(省令事項)。
あわせて、再審査期間についても、現在は効能追加や剤形
追加を前提として4年以上6年未満となっていることから、
申請区分に応じて再審査期間が設定されるよう見直すこと
とする。
再審査期間の延長上限
成人の開発時の
小児開発計画策定
特定用途医薬品の対象申請区分(現行)
延長上限を12年に引き上げ
① 用法又は用量の変更
② 剤形の追加
臨床試験
承認審査
臨床開発
努力義務化
通常効能
10
年
開発計画
策定
8年
小児
非臨床
小児開発に
より延長可
成人
再審査期間
延長上限10年(現行)
オーファン
•
新有効成分含有医薬品等は含まれない
•
薬機法等において、特定用途医薬品の再審査期間
は、4年以上6年未満とされている
4