よむ、つかう、まなぶ。
総-2-3令和7年11月薬価収載予定の新薬のうち14日ルールの例外的な取扱いをすることについて(案)[120KB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_65606.html |
| 出典情報 | 中央社会保険医療協議会 総会(第624回 11/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
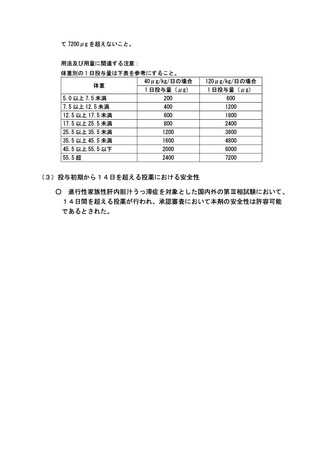
て 7200μg を超えないこと。
用法及び用量に関連する注意:
体重別の 1 日投与量は下表を参考にすること。
40μg/kg/日の場合
体重
1 日投与量(μg)
5.0 以上 7.5 未満
200
120μg/kg/日の場合
1 日投与量(μg)
600
7.5 以上 12.5 未満
400
1200
12.5 以上 17.5 未満
17.5 以上 25.5 未満
25.5 以上 35.5 未満
600
800
1200
1800
2400
3600
35.5 以上 45.5 未満
45.5 以上 55.5 以下
1600
2000
4800
6000
55.5 超
2400
7200
(3)投与初期から14日を超える投薬における安全性
○
進行性家族性肝内胆汁うっ滞症を対象とした国内外の第Ⅲ相試験において、
14日間を超える投薬が行われ、承認審査において本剤の安全性は許容可能
であるとされた。
3
用法及び用量に関連する注意:
体重別の 1 日投与量は下表を参考にすること。
40μg/kg/日の場合
体重
1 日投与量(μg)
5.0 以上 7.5 未満
200
120μg/kg/日の場合
1 日投与量(μg)
600
7.5 以上 12.5 未満
400
1200
12.5 以上 17.5 未満
17.5 以上 25.5 未満
25.5 以上 35.5 未満
600
800
1200
1800
2400
3600
35.5 以上 45.5 未満
45.5 以上 55.5 以下
1600
2000
4800
6000
55.5 超
2400
7200
(3)投与初期から14日を超える投薬における安全性
○
進行性家族性肝内胆汁うっ滞症を対象とした国内外の第Ⅲ相試験において、
14日間を超える投薬が行われ、承認審査において本剤の安全性は許容可能
であるとされた。
3