よむ、つかう、まなぶ。
総ー2参考 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64741.html |
| 出典情報 | 中央社会保険医療協議会 総会(第621回 10/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
後発医薬品とバイオ後続品の取扱状況
○ 後発医薬品とバイオ後続品における、薬剤の特性や診療報酬上の評価等の違いは、以下のとおり。
後発医薬品
バイオ後続品
定義
先発医薬品と同一の有効成分を同一量含み、同一
経路から投与する製剤で、効能・効果、用法・用
量が原則的に同一であり、先発医薬品と同等の臨
床効果・作用が得られる医薬品。
新有効成分含有医薬品として承認されたバイオテクノロ
ジー応用医薬品(先行バイオ医薬品)と同等/同質の品
質、安全性及び有効性を有する医薬品。
有効成分の品質特性
有効成分、成分量等が先発品と同一
品質・有効性等が先行バイオ医薬品と同等/同質である
(同一性の検証は困難)
臨床試験
生物学的同等性試験による評価(第Ⅰ相試験)
同等性/同質性評価の治験が必要(第Ⅰ相、第Ⅲ相試験)
→「バイオ後続品の品質・安全性・有効性確保のための指
針」
製造販売後調査
原則
原則
診療報酬上の評価
一般名処方加算:医科
外来後発医薬品使用体制加算:医科
後発医薬品調剤体制加算:調剤
バイオ後続品使用体制加算(R6新設):医科
バイオ後続品導入初期加算:医科
薬剤の特性
内服薬が多い
ほぼ注射薬
処方方法
一般名処方
銘柄名処方
変更調剤
可(不可の場合は、処方箋に変更不可欄に記載)
不可
実施しない
実施する
出典:薬生薬審発0204第1号「バイオ後続品の品質・安全性・有効性確保のための指針」改訂版(令和2年2月4日)
https://www.nihs.go.jp/dbcb/TEXT/yakuseiyakushinnhatsu_0204_1.pdf
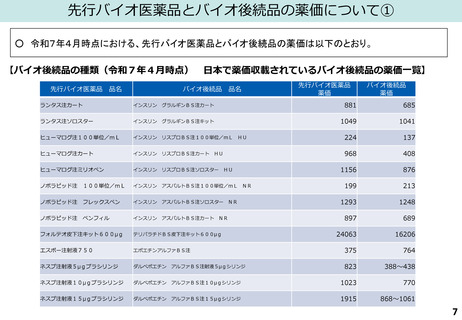
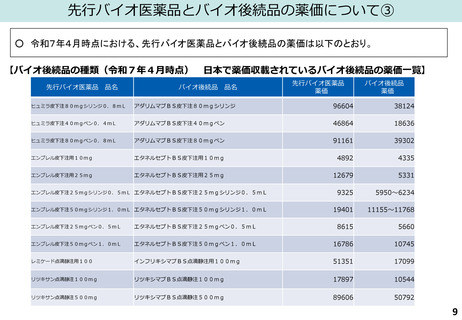
(図表)日本バイオシミラー協議会HP(「日本で承認されているバイオシミラー一覧<2025年6月1日時点>」)、
国立医薬品食品衛生研究所「日本で承認されたバイオ後続品<2025年1月6日>」より作成
6
○ 後発医薬品とバイオ後続品における、薬剤の特性や診療報酬上の評価等の違いは、以下のとおり。
後発医薬品
バイオ後続品
定義
先発医薬品と同一の有効成分を同一量含み、同一
経路から投与する製剤で、効能・効果、用法・用
量が原則的に同一であり、先発医薬品と同等の臨
床効果・作用が得られる医薬品。
新有効成分含有医薬品として承認されたバイオテクノロ
ジー応用医薬品(先行バイオ医薬品)と同等/同質の品
質、安全性及び有効性を有する医薬品。
有効成分の品質特性
有効成分、成分量等が先発品と同一
品質・有効性等が先行バイオ医薬品と同等/同質である
(同一性の検証は困難)
臨床試験
生物学的同等性試験による評価(第Ⅰ相試験)
同等性/同質性評価の治験が必要(第Ⅰ相、第Ⅲ相試験)
→「バイオ後続品の品質・安全性・有効性確保のための指
針」
製造販売後調査
原則
原則
診療報酬上の評価
一般名処方加算:医科
外来後発医薬品使用体制加算:医科
後発医薬品調剤体制加算:調剤
バイオ後続品使用体制加算(R6新設):医科
バイオ後続品導入初期加算:医科
薬剤の特性
内服薬が多い
ほぼ注射薬
処方方法
一般名処方
銘柄名処方
変更調剤
可(不可の場合は、処方箋に変更不可欄に記載)
不可
実施しない
実施する
出典:薬生薬審発0204第1号「バイオ後続品の品質・安全性・有効性確保のための指針」改訂版(令和2年2月4日)
https://www.nihs.go.jp/dbcb/TEXT/yakuseiyakushinnhatsu_0204_1.pdf
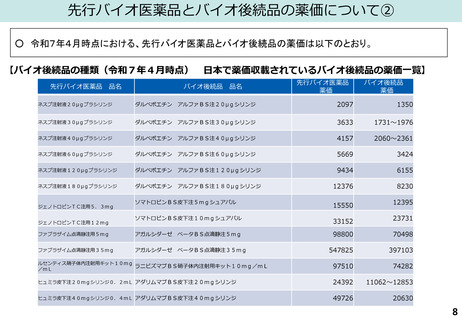
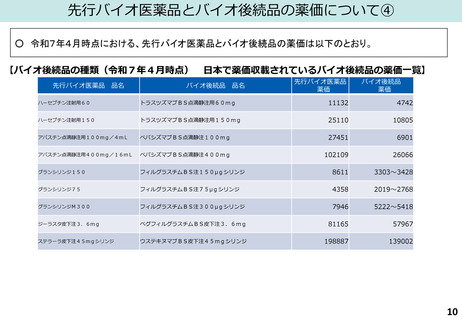
(図表)日本バイオシミラー協議会HP(「日本で承認されているバイオシミラー一覧<2025年6月1日時点>」)、
国立医薬品食品衛生研究所「日本で承認されたバイオ後続品<2025年1月6日>」より作成
6