よむ、つかう、まなぶ。
総-1-1条件及び期限付き承認された再生医療等製品に対する対応 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64319.html |
| 出典情報 | 中央社会保険医療協議会 総会(第619回 10/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
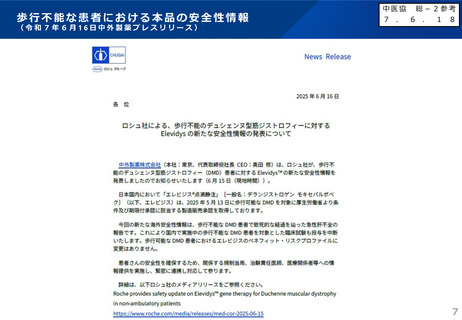
エレビジス点滴静注の安全性について(総-1-2)
急性肝不全関連事象に係る対応について
<対応の概要>
○ 中外製薬が本年6月に発生した急性肝不全関連事象への対応について厚生労働省及びPMDAに相
談。
○
報告症例に基づき、PMDAにおいて安全対策を検討、専門家の意見聴取(専門協議)を実施。
「「使用上の注意」の改訂について」(令和7年8月28日付け医薬安発0828第1号)を発出。
以下のとおり、添付文書の改訂を指示。
<添付文書改定(案)の概要>
1.
「8. 重要な基本的注意」の項における肝機能検査に関する注意喚起に、急性肝不全に関連する検査項目及び
画像検査を行うこと、及び異常が認められた場合には投与の延期等の適切な対応を行うことを追記。
2.
「8. 重要な基本的注意」の項に、副腎皮質ステロイドの投与による感染症に関する注意喚起を追記し、感染
症を合併している患者に対する注意喚起を「9. 特定の背景を有する患者に関する注意」の「9.1 合併症・既
往歴等のある患者」の項に移行。
3.
「11.1 重大な副作用」の「11.1.2 肝機能障害」の項に「急性肝不全」を追記し、歩行不能患者への本品投
与後に死亡に至った症例が海外で報告されている旨を追記。
4
急性肝不全関連事象に係る対応について
<対応の概要>
○ 中外製薬が本年6月に発生した急性肝不全関連事象への対応について厚生労働省及びPMDAに相
談。
○
報告症例に基づき、PMDAにおいて安全対策を検討、専門家の意見聴取(専門協議)を実施。
「「使用上の注意」の改訂について」(令和7年8月28日付け医薬安発0828第1号)を発出。
以下のとおり、添付文書の改訂を指示。
<添付文書改定(案)の概要>
1.
「8. 重要な基本的注意」の項における肝機能検査に関する注意喚起に、急性肝不全に関連する検査項目及び
画像検査を行うこと、及び異常が認められた場合には投与の延期等の適切な対応を行うことを追記。
2.
「8. 重要な基本的注意」の項に、副腎皮質ステロイドの投与による感染症に関する注意喚起を追記し、感染
症を合併している患者に対する注意喚起を「9. 特定の背景を有する患者に関する注意」の「9.1 合併症・既
往歴等のある患者」の項に移行。
3.
「11.1 重大な副作用」の「11.1.2 肝機能障害」の項に「急性肝不全」を追記し、歩行不能患者への本品投
与後に死亡に至った症例が海外で報告されている旨を追記。
4