よむ、つかう、まなぶ。
(別紙1)[867KB]新規技術(8月受理分)の先進医療A又は先進医療Bへの振り分けについて(案) (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00107.html |
| 出典情報 | 先進医療会議(第145回 8/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
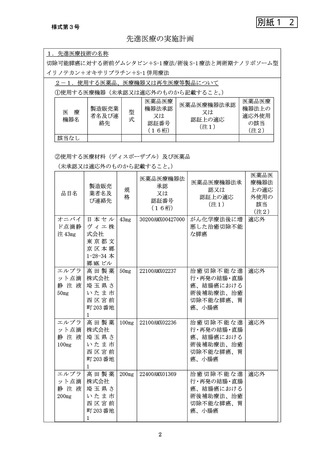
1. 一般名:イリノテカン塩酸塩水和物リポソーム製剤(製品名:オニバイド/製造販
売元:日本セルヴィエ株式会社)、効能効果:がん化学療法後に増悪した治癒切除不
能な膵癌、用法用量:フルオロウラシル及びレボホリナートとの併用において、通
常、成人にはイリノテカンとして 1 回 70mg/m2(体表面積)を 90 分かけて 2 週間間
隔で点滴静注する。なお、患者の状態により適宜減量する。
2. 一般名:オキサリプラチン(製品名:エルプラット/製造販売元:株式会社ヤクルト
本社/販売元:高田製薬株式会社)、効能効果:治癒切除不能な膵癌、用法用量:他の
2
抗悪性腫瘍剤との併用において、通常、成人にはオキサリプラチンとして 85mg/m(体
表面積)を 1 日 1 回静脈内に 2 時間で点滴投与し、少なくとも 13 日間休薬する。こ
れを 1 サイクルとして投与を繰り返す。
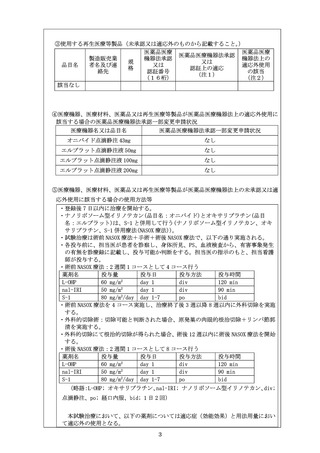
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び取
得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法
で承認された適応の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況
米国では、nal-IRI は治癒切除不能な膵癌を対象に薬事承認されているが、切除可能膵癌
に対しては術前投与、術後投与共に薬事承認されていない。National Comprehensive
Cancer Network(NCCN)の膵癌治療ガイドラインでは、切除可能膵癌に対する術前化学療法
の確立したエビデンスはまだ存在しないと考えられており、画像所見、CA19-9 が非常に高
値であること、大きな原発性腫瘍、大きな局所リンパ節、高度の体重減少、高度の疼痛など
の所見を有する高リスク患者の場合、術前化学療法を考慮すると記載されている。術前化学
療法のレジメンに関しては、特定のレジメンを推奨するにはエビデンスが少なく、特に規定
されていないが、望ましいレジメンとして、mFOLFIRINOX 療法と GEM+nab-PTX 療法が示さ
れている。
欧州での薬事承認の状況
欧州では、nal-IRI は治癒切除不能な膵癌に対して薬事承認されているが、切除可能膵癌に
対しては術前投与、術後投与共に薬事承認されていない。European Society for Medical
Oncology(ESMO)の膵癌治療ガイドラインでは、切除可能膵癌に対する術前化学療法のエビ
デンスは乏しく、有益性は確立していないため臨床試験以外では推奨されていない。
4
売元:日本セルヴィエ株式会社)、効能効果:がん化学療法後に増悪した治癒切除不
能な膵癌、用法用量:フルオロウラシル及びレボホリナートとの併用において、通
常、成人にはイリノテカンとして 1 回 70mg/m2(体表面積)を 90 分かけて 2 週間間
隔で点滴静注する。なお、患者の状態により適宜減量する。
2. 一般名:オキサリプラチン(製品名:エルプラット/製造販売元:株式会社ヤクルト
本社/販売元:高田製薬株式会社)、効能効果:治癒切除不能な膵癌、用法用量:他の
2
抗悪性腫瘍剤との併用において、通常、成人にはオキサリプラチンとして 85mg/m(体
表面積)を 1 日 1 回静脈内に 2 時間で点滴投与し、少なくとも 13 日間休薬する。こ
れを 1 サイクルとして投与を繰り返す。
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び取
得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法
で承認された適応の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況
米国では、nal-IRI は治癒切除不能な膵癌を対象に薬事承認されているが、切除可能膵癌
に対しては術前投与、術後投与共に薬事承認されていない。National Comprehensive
Cancer Network(NCCN)の膵癌治療ガイドラインでは、切除可能膵癌に対する術前化学療法
の確立したエビデンスはまだ存在しないと考えられており、画像所見、CA19-9 が非常に高
値であること、大きな原発性腫瘍、大きな局所リンパ節、高度の体重減少、高度の疼痛など
の所見を有する高リスク患者の場合、術前化学療法を考慮すると記載されている。術前化学
療法のレジメンに関しては、特定のレジメンを推奨するにはエビデンスが少なく、特に規定
されていないが、望ましいレジメンとして、mFOLFIRINOX 療法と GEM+nab-PTX 療法が示さ
れている。
欧州での薬事承認の状況
欧州では、nal-IRI は治癒切除不能な膵癌に対して薬事承認されているが、切除可能膵癌に
対しては術前投与、術後投与共に薬事承認されていない。European Society for Medical
Oncology(ESMO)の膵癌治療ガイドラインでは、切除可能膵癌に対する術前化学療法のエビ
デンスは乏しく、有益性は確立していないため臨床試験以外では推奨されていない。
4