よむ、つかう、まなぶ。
資料2-3 国立がん研究センター中央病院提出資料 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58540.html |
| 出典情報 | 特定機能病院及び地域医療支援病院のあり方に関する検討会(第25回 6/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
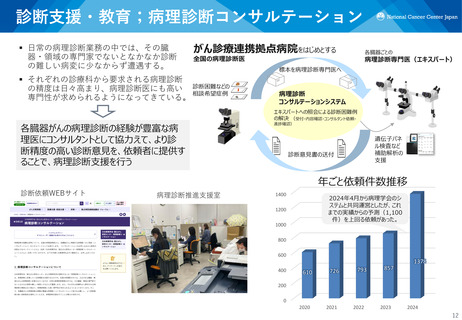
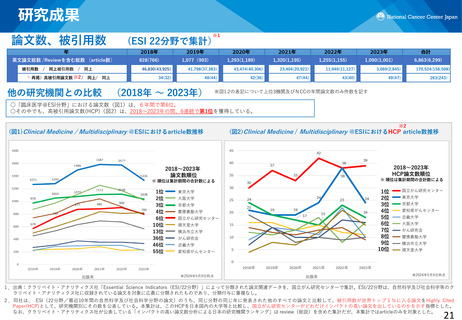
医療提供;新しい形のネットワーク
ATLASプロジェクト
MASTER KEY Project
✓ 産学患共同の希少がん開発プラットフォーム試験
✓ 網羅的な臨床ゲノムデータベース + 複数の副試験(医師主導治験・企
業治験)
✓ レジストリを対照データとして活用し、単群試験で適応拡大を目指す
医師主導治験を複数実施
✓ 治療の機会が限られていた希少がん患者に、治験の実施を通じてより
多くの新薬を届ける
実施状況:2025.3末
レジストリ登録(累計)
日本(11施設)
4766例
アジア(7か国26施設)935例
副試験(計33試験、登録中6試験)
医師主導治験 16試験
企業治験
17試験
薬事承認が得られた副試験
医師主導治験 3試験
企業治験
2試験
✓ アジア9か国を中心とした、AMEDアジアがん臨床試験ネットワーク
構築事業
✓ 2020年より開始し、アジアでの国際共同研究を6課題実施
✓ 開始から4年あまりで、アジア9か国、40施設から2,700人を超える
患者登録
✓ アジア8か国の代表からなるATLAS boardを設立し、アジア全体で
意思決定
✓ 頭頸部がん、肉腫・希少がん、肝胆膵がんの臓器別グループを設立
✓ ATLAS Monthly Webinarを毎月開催。アジア各国の研究者が登壇し、
参加者の3分の2は日本以外から
アジア試験の例:PATHWAY
アジア試験の例:Project CAD
アカデミア連携
日本(11施設) アジア(8か国28施設)
✓ 日本で開発された大腸内視鏡AI診
✓ 中央病院主導の日本、韓国、台湾、 断支援ツール(CADe)を用いた、
シンガポールのアジア共同医師主
アジア6つの国・地域、1,400例の
導治験
大規模ランダム化比較第III相試験
✓ Primary endpointである無増悪生
(日本、韓国、台湾、中国(香港)、
存期間が延長し、Palbociclibの
タイ、シンガポール)
Tamoxifen併用による使用につい ✓ 予定の2倍のペースで登録が進み、
て日本で薬事承認(2024年1月)
1年あまりで1,400例の登録完了
患者連携
企業連携
日本レジストリ参加企業
アジアレジストリ参加企業
12企業
3企業
MASTER KEY
Projectの詳細は
ホームページも
ご覧ください
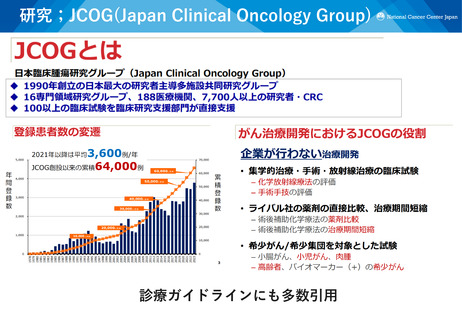
ATLASプロジェクト
MASTER KEY Project
✓ 産学患共同の希少がん開発プラットフォーム試験
✓ 網羅的な臨床ゲノムデータベース + 複数の副試験(医師主導治験・企
業治験)
✓ レジストリを対照データとして活用し、単群試験で適応拡大を目指す
医師主導治験を複数実施
✓ 治療の機会が限られていた希少がん患者に、治験の実施を通じてより
多くの新薬を届ける
実施状況:2025.3末
レジストリ登録(累計)
日本(11施設)
4766例
アジア(7か国26施設)935例
副試験(計33試験、登録中6試験)
医師主導治験 16試験
企業治験
17試験
薬事承認が得られた副試験
医師主導治験 3試験
企業治験
2試験
✓ アジア9か国を中心とした、AMEDアジアがん臨床試験ネットワーク
構築事業
✓ 2020年より開始し、アジアでの国際共同研究を6課題実施
✓ 開始から4年あまりで、アジア9か国、40施設から2,700人を超える
患者登録
✓ アジア8か国の代表からなるATLAS boardを設立し、アジア全体で
意思決定
✓ 頭頸部がん、肉腫・希少がん、肝胆膵がんの臓器別グループを設立
✓ ATLAS Monthly Webinarを毎月開催。アジア各国の研究者が登壇し、
参加者の3分の2は日本以外から
アジア試験の例:PATHWAY
アジア試験の例:Project CAD
アカデミア連携
日本(11施設) アジア(8か国28施設)
✓ 日本で開発された大腸内視鏡AI診
✓ 中央病院主導の日本、韓国、台湾、 断支援ツール(CADe)を用いた、
シンガポールのアジア共同医師主
アジア6つの国・地域、1,400例の
導治験
大規模ランダム化比較第III相試験
✓ Primary endpointである無増悪生
(日本、韓国、台湾、中国(香港)、
存期間が延長し、Palbociclibの
タイ、シンガポール)
Tamoxifen併用による使用につい ✓ 予定の2倍のペースで登録が進み、
て日本で薬事承認(2024年1月)
1年あまりで1,400例の登録完了
患者連携
企業連携
日本レジストリ参加企業
アジアレジストリ参加企業
12企業
3企業
MASTER KEY
Projectの詳細は
ホームページも
ご覧ください