よむ、つかう、まなぶ。
○最適使用推進ガイドラインについて-5-2 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00142.html |
| 出典情報 | 中央社会保険医療協議会 総会(第518回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3.臨床成績
がん化学療法後に増悪した高い腫瘍遺伝子変異量(以下「TMB-High」という。)を有
する進行・再発の固形癌(標準的な治療が困難な場合に限る)の承認時に評価を行った
主な臨床試験の成績を示す。
【有効性】
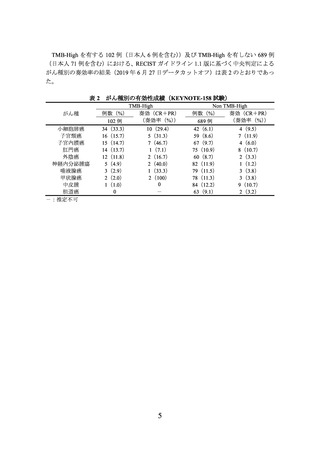
国際共同第Ⅱ相試験(KEYNOTE-158 試験)
化学療法歴*1 のある進行・再発の固形癌患者(がん種ごとに分けた A~L の各グルー
プ*2 において約 200~1,595 例)を対象に、本剤 200 mg 3 週間間隔(以下「Q3W」とい
う。)投与の有効性及び安全性が検討された。本剤の有効性は、FoundationOne CDx によ
り TMB スコア*3 が 10 mutations/megabase(mut/Mb)以上と算出された場合に TMB-High
と判定することとし、解析計画に従って、グループ A~J に登録された固形癌患者につ
いて解析が行われた。
TMB-High を有する 102 例(日本人 6 例を含む)及び TMB-High を有しない 689 例
(日本人 71 例を含む)における、主要評価項目である RECIST ガイドライン 1.1 版に
基づく中央判定による奏効率の結果(2019 年 6 月 27 日データカットオフ)は表 1 のと
おりであった。
*1:一次治療として標準的に実施されている化学療法並びに日常診療で用いられている手
術及び放射線療法を含む治療に抵抗性又は不耐容の患者が組み入れられた。
*2:各グループにおいて、それぞれ以下の患者が組み入れられた。
A:肛門癌(扁平上皮癌)、B:胆道癌(胆嚢及び胆管の腺癌、ただしファーター膨大部腫瘍
を除く)
、C:肺、虫垂、小腸、結腸、直腸及び膵臓由来の神経内分泌腫瘍(高分化型又は中
分化型神経内分泌腫瘍)、D:子宮内膜癌(肉腫又は間葉系腫瘍を除く)、E:子宮頸癌(扁
平上皮癌)
、F:外陰癌(扁平上皮癌)
、G:小細胞肺癌、H:中皮腫、I:甲状腺癌、J:唾液
腺癌(肉腫又は間葉系腫瘍を除く)、K:高頻度マイクロサテライト不安定性(以下「MSIHigh」という。)を有する進行性固形癌(結腸・直腸癌を除く)、L(中国のみ)
:MSI-High を
有する進行性固形癌
*3:5%以上のアレル頻度で検出された同義変異及び非同義変異から、生殖細胞系列の変異
及び既知又は機能的意義があると考えられる変異を除いた百万塩基あたりの変異の数
(mut/Mb)
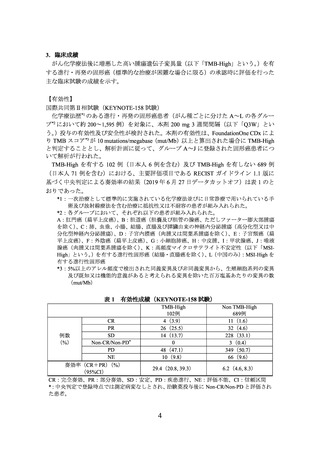
表 1 有効性成績(KEYNOTE-158 試験)
TMB-High
102例
4(3.9)
26(25.5)
14(13.7)
0
48(47.1)
10(9.8)
Non TMB-High
689例
11(1.6)
32(4.6)
228(33.1)
3(0.4)
349(50.7)
66(9.6)
CR
PR
SD
例数
(%)
Non-CR/Non-PD*
PD
NE
奏効率(CR+PR)(%)
29.4(20.8, 39.3)
6.2(4.6, 8.3)
(95%CI)
CR:完全奏効、PR:部分奏効、SD:安定、PD:疾患進行、NE:評価不能、CI:信頼区間
*:中央判定で登録時点では測定病変なしとされ、治験薬投与後に Non-CR/Non-PD と評価され
た患者。
4
がん化学療法後に増悪した高い腫瘍遺伝子変異量(以下「TMB-High」という。)を有
する進行・再発の固形癌(標準的な治療が困難な場合に限る)の承認時に評価を行った
主な臨床試験の成績を示す。
【有効性】
国際共同第Ⅱ相試験(KEYNOTE-158 試験)
化学療法歴*1 のある進行・再発の固形癌患者(がん種ごとに分けた A~L の各グルー
プ*2 において約 200~1,595 例)を対象に、本剤 200 mg 3 週間間隔(以下「Q3W」とい
う。)投与の有効性及び安全性が検討された。本剤の有効性は、FoundationOne CDx によ
り TMB スコア*3 が 10 mutations/megabase(mut/Mb)以上と算出された場合に TMB-High
と判定することとし、解析計画に従って、グループ A~J に登録された固形癌患者につ
いて解析が行われた。
TMB-High を有する 102 例(日本人 6 例を含む)及び TMB-High を有しない 689 例
(日本人 71 例を含む)における、主要評価項目である RECIST ガイドライン 1.1 版に
基づく中央判定による奏効率の結果(2019 年 6 月 27 日データカットオフ)は表 1 のと
おりであった。
*1:一次治療として標準的に実施されている化学療法並びに日常診療で用いられている手
術及び放射線療法を含む治療に抵抗性又は不耐容の患者が組み入れられた。
*2:各グループにおいて、それぞれ以下の患者が組み入れられた。
A:肛門癌(扁平上皮癌)、B:胆道癌(胆嚢及び胆管の腺癌、ただしファーター膨大部腫瘍
を除く)
、C:肺、虫垂、小腸、結腸、直腸及び膵臓由来の神経内分泌腫瘍(高分化型又は中
分化型神経内分泌腫瘍)、D:子宮内膜癌(肉腫又は間葉系腫瘍を除く)、E:子宮頸癌(扁
平上皮癌)
、F:外陰癌(扁平上皮癌)
、G:小細胞肺癌、H:中皮腫、I:甲状腺癌、J:唾液
腺癌(肉腫又は間葉系腫瘍を除く)、K:高頻度マイクロサテライト不安定性(以下「MSIHigh」という。)を有する進行性固形癌(結腸・直腸癌を除く)、L(中国のみ)
:MSI-High を
有する進行性固形癌
*3:5%以上のアレル頻度で検出された同義変異及び非同義変異から、生殖細胞系列の変異
及び既知又は機能的意義があると考えられる変異を除いた百万塩基あたりの変異の数
(mut/Mb)
表 1 有効性成績(KEYNOTE-158 試験)
TMB-High
102例
4(3.9)
26(25.5)
14(13.7)
0
48(47.1)
10(9.8)
Non TMB-High
689例
11(1.6)
32(4.6)
228(33.1)
3(0.4)
349(50.7)
66(9.6)
CR
PR
SD
例数
(%)
Non-CR/Non-PD*
PD
NE
奏効率(CR+PR)(%)
29.4(20.8, 39.3)
6.2(4.6, 8.3)
(95%CI)
CR:完全奏効、PR:部分奏効、SD:安定、PD:疾患進行、NE:評価不能、CI:信頼区間
*:中央判定で登録時点では測定病変なしとされ、治験薬投与後に Non-CR/Non-PD と評価され
た患者。
4