よむ、つかう、まなぶ。
資料1-1 医薬品等の使用上の注意の改訂について [294KB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第3回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
No.
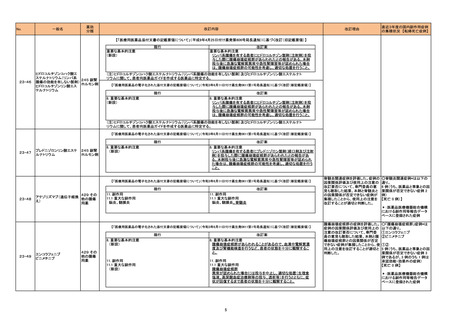
23-54
一般名
ニンテダニブエタンスルホン
酸塩
アキシチニブ
アフリベルセプト ベータ(遺
伝子組換え)
カボザンチニブリンゴ酸塩
スニチニブリンゴ酸塩
ソラフェニブトシル酸塩
パゾパニブ塩酸塩
バンデタニブ
ポナチニブ塩酸塩
ラムシルマブ(遺伝子組換
え)
レゴラフェニブ水和物
レンバチニブメシル酸塩
薬効
分類
改訂内容
改訂理由
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂 (新記載要領)】
現行
399 他に
分類されな
い代謝性
医薬品
429 その
他の腫瘍
用薬
11. 副作用
11.1 重大な副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
動脈解離
大動脈解離を含む動脈解離があらわれることがある。
【参考】NDB を用いた調査結果の概要(VEGF/VEGFR 阻害作用を有する薬剤の動脈解離に関するリスク評価):
https://www.pmda.go.jp/files/000266521.pdf
【「医療用医薬品添付文書の記載要領について」(平成9年4月25日付け薬発第606号局長通知)に基づく改訂 (旧記載要領)】
現行
副作用
重大な副作用
(新設)
23-55
リネゾリド
改訂案
副作用
重大な副作用
横紋筋融解症:
横紋筋融解症があらわれることがあるので、観察を十分に行い、
筋肉痛、脱力感、CK(CPK)上昇、血中及び尿中ミオグロビン上昇
等があらわれた場合には、投与を中止し、適切な処置を行うこ
と。また、横紋筋融解症による急性腎障害の発症に注意するこ
と。
624 合成
抗菌剤
直近3年度の国内副作用症例
の集積状況 【転帰死亡症例】
VEGF 又 は VEGF 受容体の阻害作 用を有する薬剤(以下、
「VEGF/VEGFR 阻害剤」)の動脈解
離のリスクに関するレセプト情報・特
定健診等情報データベースを用いた
調査結果の概要(別添:
https://www.pmda.go.jp/files/00026
6521.pdf)、VEGF/VEGFR 阻害剤の
薬理学的機序等を踏まえ、動脈解離
はVEGF/VEGFR 阻害剤に共通のリ
スクであると判断した。
上述の機構見解の適切性及び動脈
解離に係る安全対策措置の必要性
について、専門委員の意見も聴取し
た結果、VEGF/VEGFR 阻害剤の使
用上の注意を改訂することが適切と
判断した。
横紋筋融解症関連症例を評価した。 ○横紋筋融解症関連症例*は
症例の因果関係評価及び使用上の 以下の通り。
注意の改訂要否について、専門委 3 例(うち、医薬品と事象との因
員の意見も聴取した結果、本剤と横 果関係が否定できない症例 1
紋筋融解症との因果関係が否定で 例)
きない症例が集積したことから、使 【死亡 1 例(うち、医薬品と事象
用上の注意を改訂することが適切と による死亡との因果関係が否
判断した。
定できない症例 0 例)】
*:医薬品医療機器総合機構
における副作用等報告データ
ベースに登録された症例
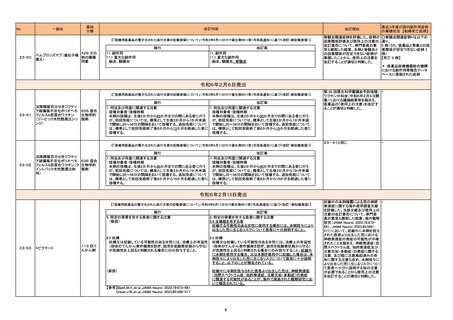
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂 (新記載要領)】
現行
11. 副作用
11.1 重大な副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
横紋筋融解症
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等があ
らわれた場合には、投与を中止し、適切な処置を行うこと。ま
た、横紋筋融解症による急性腎障害の発症に注意すること。
【「医療用医薬品添付文書の記載要領について」(平成9年4月25日付け薬発第606号局長通知)に基づく改訂 (旧記載要領)】
現行
副作用
重大な副作用
(新設)
23-56
イトラコナゾール
629 その
他の化学
療法剤
改訂案
副作用
重大な副作用
偽アルドステロン症:
低カリウム血症、血圧上昇、ナトリウム・体液の貯留、浮腫、体
重増加等があらわれることがあるので、観察を十分に行い、異常
が認められた場合には投与を中止し、適切な処置を行うこと。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂 (新記載要領)】
現行
11. 副作用
11.1 重大な副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
偽アルドステロン症
低カリウム血症、血圧上昇、ナトリウム・体液の貯留、浮腫、体
重増加等があらわれることがある。
7
偽アルドステロン症関連症例を評価 ○偽アルドステロン症関連症例
した。症例の因果関係評価及び使用 *は以下の通り。
上の注意の改訂要否について、専 2 例(うち、医薬品と事象との因
門委員の意見も聴取した結果、本剤 果関係が否定できない症例 1
と偽アルドステロン症との因果関係 例)
の否定できない症例が集積したこと 【死亡 0 例】
から、使用上の注意を改訂すること
が適切と判断した。
23-54
一般名
ニンテダニブエタンスルホン
酸塩
アキシチニブ
アフリベルセプト ベータ(遺
伝子組換え)
カボザンチニブリンゴ酸塩
スニチニブリンゴ酸塩
ソラフェニブトシル酸塩
パゾパニブ塩酸塩
バンデタニブ
ポナチニブ塩酸塩
ラムシルマブ(遺伝子組換
え)
レゴラフェニブ水和物
レンバチニブメシル酸塩
薬効
分類
改訂内容
改訂理由
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂 (新記載要領)】
現行
399 他に
分類されな
い代謝性
医薬品
429 その
他の腫瘍
用薬
11. 副作用
11.1 重大な副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
動脈解離
大動脈解離を含む動脈解離があらわれることがある。
【参考】NDB を用いた調査結果の概要(VEGF/VEGFR 阻害作用を有する薬剤の動脈解離に関するリスク評価):
https://www.pmda.go.jp/files/000266521.pdf
【「医療用医薬品添付文書の記載要領について」(平成9年4月25日付け薬発第606号局長通知)に基づく改訂 (旧記載要領)】
現行
副作用
重大な副作用
(新設)
23-55
リネゾリド
改訂案
副作用
重大な副作用
横紋筋融解症:
横紋筋融解症があらわれることがあるので、観察を十分に行い、
筋肉痛、脱力感、CK(CPK)上昇、血中及び尿中ミオグロビン上昇
等があらわれた場合には、投与を中止し、適切な処置を行うこ
と。また、横紋筋融解症による急性腎障害の発症に注意するこ
と。
624 合成
抗菌剤
直近3年度の国内副作用症例
の集積状況 【転帰死亡症例】
VEGF 又 は VEGF 受容体の阻害作 用を有する薬剤(以下、
「VEGF/VEGFR 阻害剤」)の動脈解
離のリスクに関するレセプト情報・特
定健診等情報データベースを用いた
調査結果の概要(別添:
https://www.pmda.go.jp/files/00026
6521.pdf)、VEGF/VEGFR 阻害剤の
薬理学的機序等を踏まえ、動脈解離
はVEGF/VEGFR 阻害剤に共通のリ
スクであると判断した。
上述の機構見解の適切性及び動脈
解離に係る安全対策措置の必要性
について、専門委員の意見も聴取し
た結果、VEGF/VEGFR 阻害剤の使
用上の注意を改訂することが適切と
判断した。
横紋筋融解症関連症例を評価した。 ○横紋筋融解症関連症例*は
症例の因果関係評価及び使用上の 以下の通り。
注意の改訂要否について、専門委 3 例(うち、医薬品と事象との因
員の意見も聴取した結果、本剤と横 果関係が否定できない症例 1
紋筋融解症との因果関係が否定で 例)
きない症例が集積したことから、使 【死亡 1 例(うち、医薬品と事象
用上の注意を改訂することが適切と による死亡との因果関係が否
判断した。
定できない症例 0 例)】
*:医薬品医療機器総合機構
における副作用等報告データ
ベースに登録された症例
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂 (新記載要領)】
現行
11. 副作用
11.1 重大な副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
横紋筋融解症
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等があ
らわれた場合には、投与を中止し、適切な処置を行うこと。ま
た、横紋筋融解症による急性腎障害の発症に注意すること。
【「医療用医薬品添付文書の記載要領について」(平成9年4月25日付け薬発第606号局長通知)に基づく改訂 (旧記載要領)】
現行
副作用
重大な副作用
(新設)
23-56
イトラコナゾール
629 その
他の化学
療法剤
改訂案
副作用
重大な副作用
偽アルドステロン症:
低カリウム血症、血圧上昇、ナトリウム・体液の貯留、浮腫、体
重増加等があらわれることがあるので、観察を十分に行い、異常
が認められた場合には投与を中止し、適切な処置を行うこと。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂 (新記載要領)】
現行
11. 副作用
11.1 重大な副作用
(新設)
改訂案
11. 副作用
11.1 重大な副作用
偽アルドステロン症
低カリウム血症、血圧上昇、ナトリウム・体液の貯留、浮腫、体
重増加等があらわれることがある。
7
偽アルドステロン症関連症例を評価 ○偽アルドステロン症関連症例
した。症例の因果関係評価及び使用 *は以下の通り。
上の注意の改訂要否について、専 2 例(うち、医薬品と事象との因
門委員の意見も聴取した結果、本剤 果関係が否定できない症例 1
と偽アルドステロン症との因果関係 例)
の否定できない症例が集積したこと 【死亡 0 例】
から、使用上の注意を改訂すること
が適切と判断した。