よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (52 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
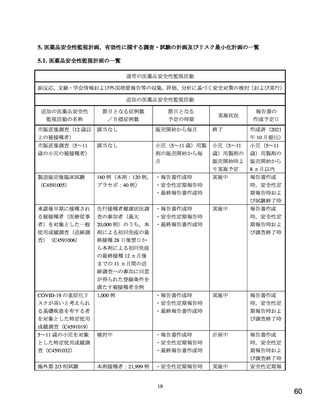
2. 医薬品安全性監視計画の概要
通常の医薬品安全性監視活動
通常の医薬品安全性監視活動の概要:
副反応,文献・学会情報および外国措置報告等の収集,評価,分析に基づく安全対策の検討(および実行)
追加の医薬品安全性監視活動
市販直後調査(5~11 歳の小児の被接種者)
実施期間:小児(5~11 歳)用製剤の販売開始後 6 ヵ月間
評価・報告の予定時期:調査終了後 2 ヵ月以内
製造販売後臨床試験(C4591005)
本剤の製造販売承認取得後,
「日本人健康成人を対象とした COVID-19 に対する SARS-COV-2 RNA
ワクチンの安全性,忍容性および免疫原性を評価する第 1/2 相,プラセボ対照,無作為化,観察者
盲検試験」(C4591005 試験)を製造販売後臨床試験に切り替え継続実施する。
【安全性検討事項】
ワクチン接種に伴う疾患増強(VAED)およびワクチン関連の呼吸器疾患増強(VAERD)
【目的】
20~85 歳の健康成人を対象に,本剤 2 回目接種 12 ヵ月後まで追跡し,追跡期間中に認められた
重篤な有害事象および COVID-19 の情報を収集し,長期の安全性および免疫原性を評価する。
【実施計画】
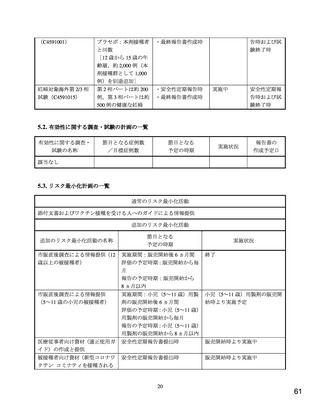
実施期間:承認日~2022 年 2 月
対象者数:160 例(本剤:120 例,プラセボ:40 例)
【実施計画の根拠】
本剤は新規性の高いワクチンであり,承認時までに得られる接種後の長期的な安全性情報は限
られている。本試験は国内第 1/2 相試験として開始しており,承認時点で製造販売後臨床試験に
切り替え,本剤接種後の長期的な安全性および COVID-19 の情報を収集する。また,6 ヵ月時,
12 ヵ月時に,免疫原性評価のための採血を行う。
【節目となる予定の時期及びその根拠】
報告書作成時,安全性定期報告時および試験終了時に安全性の検討および報告を行う。
【当該医薬品安全性監視活動の結果に基づいて実施される可能性のある追加の措置及びその開始
の決定基準】
本試験の結果を踏まえ,新たな安全性にかかわる懸念等が確認された場合または安全性検討事
項に対するリスクが明らかになった場合,医薬品リスク管理計画書の見直しを行い,更なる検
討が必要と判断する場合には,追加の医薬品安全性監視活動またはリスク最小化策の実施要否
を検討する。
承認後早期に接種される被接種者(医療従事者)を対象とした一般使用成績調査(追跡調査)(C4591006)
【安全性検討事項】
ワクチン接種に伴う疾患増強(VAED)およびワクチン関連の呼吸器疾患増強(VAERD)
妊婦または授乳婦に接種した際の安全性
【目的】
本剤の製造販売承認後早期に接種される医療従事者(厚生労働省科学研究班が実施する先行接種
11
52
通常の医薬品安全性監視活動
通常の医薬品安全性監視活動の概要:
副反応,文献・学会情報および外国措置報告等の収集,評価,分析に基づく安全対策の検討(および実行)
追加の医薬品安全性監視活動
市販直後調査(5~11 歳の小児の被接種者)
実施期間:小児(5~11 歳)用製剤の販売開始後 6 ヵ月間
評価・報告の予定時期:調査終了後 2 ヵ月以内
製造販売後臨床試験(C4591005)
本剤の製造販売承認取得後,
「日本人健康成人を対象とした COVID-19 に対する SARS-COV-2 RNA
ワクチンの安全性,忍容性および免疫原性を評価する第 1/2 相,プラセボ対照,無作為化,観察者
盲検試験」(C4591005 試験)を製造販売後臨床試験に切り替え継続実施する。
【安全性検討事項】
ワクチン接種に伴う疾患増強(VAED)およびワクチン関連の呼吸器疾患増強(VAERD)
【目的】
20~85 歳の健康成人を対象に,本剤 2 回目接種 12 ヵ月後まで追跡し,追跡期間中に認められた
重篤な有害事象および COVID-19 の情報を収集し,長期の安全性および免疫原性を評価する。
【実施計画】
実施期間:承認日~2022 年 2 月
対象者数:160 例(本剤:120 例,プラセボ:40 例)
【実施計画の根拠】
本剤は新規性の高いワクチンであり,承認時までに得られる接種後の長期的な安全性情報は限
られている。本試験は国内第 1/2 相試験として開始しており,承認時点で製造販売後臨床試験に
切り替え,本剤接種後の長期的な安全性および COVID-19 の情報を収集する。また,6 ヵ月時,
12 ヵ月時に,免疫原性評価のための採血を行う。
【節目となる予定の時期及びその根拠】
報告書作成時,安全性定期報告時および試験終了時に安全性の検討および報告を行う。
【当該医薬品安全性監視活動の結果に基づいて実施される可能性のある追加の措置及びその開始
の決定基準】
本試験の結果を踏まえ,新たな安全性にかかわる懸念等が確認された場合または安全性検討事
項に対するリスクが明らかになった場合,医薬品リスク管理計画書の見直しを行い,更なる検
討が必要と判断する場合には,追加の医薬品安全性監視活動またはリスク最小化策の実施要否
を検討する。
承認後早期に接種される被接種者(医療従事者)を対象とした一般使用成績調査(追跡調査)(C4591006)
【安全性検討事項】
ワクチン接種に伴う疾患増強(VAED)およびワクチン関連の呼吸器疾患増強(VAERD)
妊婦または授乳婦に接種した際の安全性
【目的】
本剤の製造販売承認後早期に接種される医療従事者(厚生労働省科学研究班が実施する先行接種
11
52