よむ、つかう、まなぶ。
【資料3-1】新型コロナワクチン(コミナティ筋注5~ 11 歳用)の承認について(医薬・生活衛生局の説明資料) (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
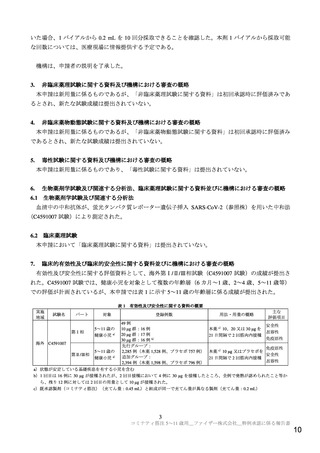
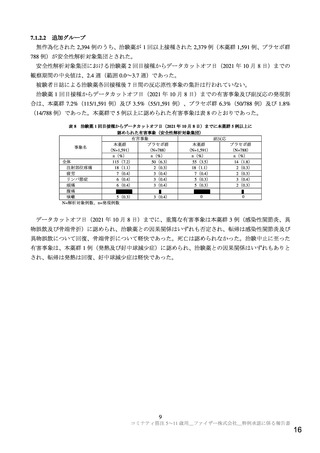
表 10
部分集団別の本薬 2 回目接種 1 カ月後の中和抗体価(Ⅱ/Ⅲ相パート
全体
性別
人種
民族
評価可能免疫原性集団)
C4591007 試験
C4591001 試験
5~11 歳、本薬 10 µg
16~25 歳、本薬 30 µg
例数 GMT[両側 95%CI]
例数
GMT[両側 95%CI]
294
1300.3[1195.9, 1413.8]
273
1192.6[1089.7, 1305.2]
男
153
1218.5[1102.8, 1346.3]
133
1081.8[ 939.2, 1245.9]
女
141
1395.3[1216.4, 1600.6]
140
1308.3[1168.1, 1465.5]
白人
232
1299.4[1178.8, 1432.4]
205
1225.6[1120.7, 1340.3]
黒人、アフリカ系アメリカ人
18
1171.2[ 823.7, 1665.4]
32
1010.3[ 657.3, 1552.9]
アジア人
23
1219.4[ 918.6, 1618.6]
17
967.9[ 641.0, 1461.3]
多民族
17
1435.8[1086.7, 1896.9]
12
1236.8[ 649.5, 2354.8]
ヒスパニック系/ラテン系
46
1412.3[1118.1, 1783.9]
98
1179.2[1046.6, 1328.6]
ヒスパニック系/ラテン系以外
246
1276.9[1166.4, 1397.9]
175
1200.2[1059.4, 1359.6]
あり
21
3270.0[2032.1, 5261.8]
13
2253.8[1497.7, 3391.5]
SARS-CoV-2 感染状況 a) なし
273
1211.3[1211.1, 1308.7]
259
1151.2[1050.5, 1261.5]
ベースライン時の
a)Visit 1 の SARS-CoV-2 N 結合抗体検査結果、核酸増幅検査結果、又は COVID-19 罹患歴の有無により判定(いずれかの検査で陽
性又は COVID-19 罹患歴ありの場合は「あり」、いずれの検査も陰性及び COVID-19 罹患歴なしの場合は「なし」)
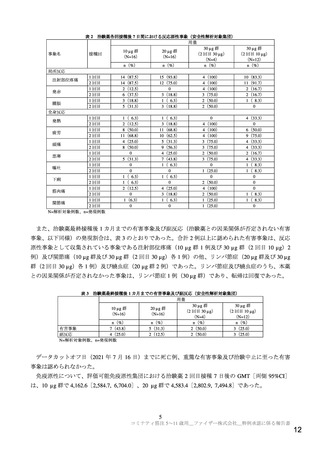
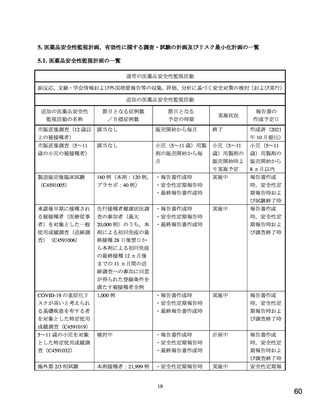
COVID-19 の重症化リスク因子の有無別の成績について、C4591007 試験と C4591001 試験では異なる
COVID-19 の重症化リスク因子の定義11)を用いたため、両試験間での比較は行わなかったが、C4591007
試験の第Ⅱ/Ⅲ相パートにおける COVID-19 の重症化リスク因子を有する集団(54 例)及び有さない集団
(210 例)の中和抗体価(GMT[両側 95%CI])はそれぞれ 1,364.0[1,170.8, 1,589.1]及び 1,158.2[1,056.6,
1,269.6]であり、COVID-19 の重症化リスク因子の有無による中和抗体価への影響は認められなかった。
また、C4591007 試験第Ⅱ/Ⅲ相パートの 5~11 歳の小児におけるデルタ株に対する免疫原性を探索的
に評価した。デルタ株に対する本薬 2 回目接種 28 日後の中和抗体価(GMT[両側 95%CI])は、294.9
[214.6, 405.3]であり、参照株に対する中和抗体価 365.3[279.0, 478.4]よりも低かった。ただし、成人
での検討においても、本薬 2 回接種 28 日後の中和抗体価(GMT[両側 95%CI])は、デルタ株に対し
て 241.0[180.1, 322.4]、参照株に対して 310.1[203.3, 473.0]であり(コミナティ筋注
特例承認に係
る報告書(令和 3 年 11 月 2 日付け))、C4591007 試験での検討結果と同様の傾向であった。
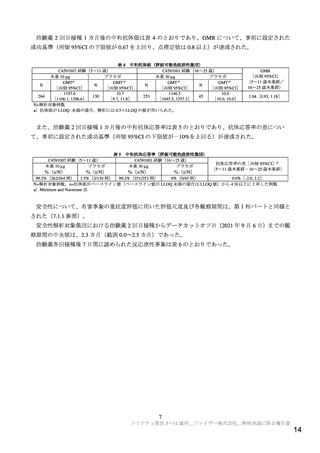
また、C4591007 試験第Ⅱ/Ⅲ相パートでは、副次評価項目として COVID-19 確定例が少なくとも 21 例
集積された時点で VE に基づく COVID-19 発症予防効果を評価する計画とされていたが、本剤の米国で
の緊急使用許可について議論する FDA の Vaccines and Related Biological Products Advisory Committee
(VRBPAC)に 5~11 歳の小児における有効性に関するデータを提供する目的で、免疫ブリッジング解
析で成功基準が達成されたことを確認後に、事前に計画されていない VE の解析を行った。当該解析は
2021 年 10 月 8 日時点のカットオフデータに基づき、試験の実施に直接関与しない非盲検の統計担当者
及びプログラミング担当者12)により実施された。データカットオフ時点までに、有効性評価可能集団13)
において治験薬 2 回目接種後 7 日以降の COVID-19 確定例14)は 19 例(本薬群 3/1,450 例及びプラセボ群
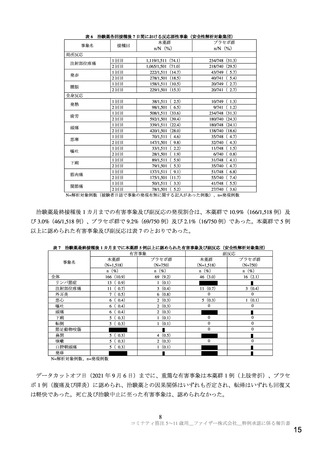
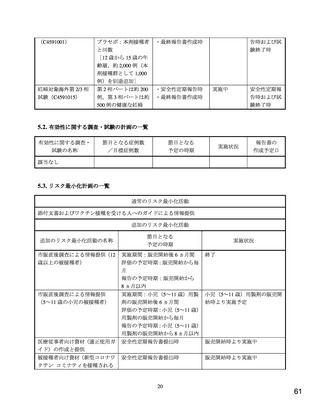
各試験において、COVID-19 の重症化リスク因子として、それぞれ以下の基礎疾患又は肥満を定義した。
C4591007 試験 基礎疾患:喘息、血液疾患、心血管疾患、慢性肺疾患、慢性代謝性疾患、先天性心臓疾患、糖尿病、経管栄養者、
免疫不全状態、神経疾患、鎌状赤血球等、肥満:CDC growth chart(https://www.cdc.gov/growthcharts/html_charts/bmiagerev.htm(最終
確認日:2021 年 12 月 10 日)における BMI パーセンタイル値が 95 パーセンタイル以上
C4591001 試験 基礎疾患:Charlson Comorbidity Index に示される疾患、肥満:BMI 30 kg/m2 以上
12)
試験の実施に関与する盲検の統計担当者及びプログラミング担当者とは別の担当者
13)
無作為化された 2,285 例のうち、1 回目接種と 2 回目接種の間隔が規定する 19~42 日の範囲外の被験者(本薬群 31 例、プラセボ群
18 例)及び 2 回目接種後 7 日までに重大な治験実施計画書の逸脱の被験者(本薬群 47 例、プラセボ群 4 例)を除く、本薬群 1,450
例、プラセボ群 736 例が有効性評価可能集団とされた。
14)
COVID-19 が疑われる症状(発熱、新たな咳嗽又は咳嗽の悪化、新たな息切れ又は息切れの悪化、悪寒、新たな筋肉痛又は筋肉痛の
悪化、新たな味覚又は嗅覚の消失、咽喉痛、下痢、嘔吐)が 1 つ以上認められ、鼻腔スワブでの核酸増幅検査により SARS-CoV-2 陽
性が確認された者と定義された。
11)
13
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
20
部分集団別の本薬 2 回目接種 1 カ月後の中和抗体価(Ⅱ/Ⅲ相パート
全体
性別
人種
民族
評価可能免疫原性集団)
C4591007 試験
C4591001 試験
5~11 歳、本薬 10 µg
16~25 歳、本薬 30 µg
例数 GMT[両側 95%CI]
例数
GMT[両側 95%CI]
294
1300.3[1195.9, 1413.8]
273
1192.6[1089.7, 1305.2]
男
153
1218.5[1102.8, 1346.3]
133
1081.8[ 939.2, 1245.9]
女
141
1395.3[1216.4, 1600.6]
140
1308.3[1168.1, 1465.5]
白人
232
1299.4[1178.8, 1432.4]
205
1225.6[1120.7, 1340.3]
黒人、アフリカ系アメリカ人
18
1171.2[ 823.7, 1665.4]
32
1010.3[ 657.3, 1552.9]
アジア人
23
1219.4[ 918.6, 1618.6]
17
967.9[ 641.0, 1461.3]
多民族
17
1435.8[1086.7, 1896.9]
12
1236.8[ 649.5, 2354.8]
ヒスパニック系/ラテン系
46
1412.3[1118.1, 1783.9]
98
1179.2[1046.6, 1328.6]
ヒスパニック系/ラテン系以外
246
1276.9[1166.4, 1397.9]
175
1200.2[1059.4, 1359.6]
あり
21
3270.0[2032.1, 5261.8]
13
2253.8[1497.7, 3391.5]
SARS-CoV-2 感染状況 a) なし
273
1211.3[1211.1, 1308.7]
259
1151.2[1050.5, 1261.5]
ベースライン時の
a)Visit 1 の SARS-CoV-2 N 結合抗体検査結果、核酸増幅検査結果、又は COVID-19 罹患歴の有無により判定(いずれかの検査で陽
性又は COVID-19 罹患歴ありの場合は「あり」、いずれの検査も陰性及び COVID-19 罹患歴なしの場合は「なし」)
COVID-19 の重症化リスク因子の有無別の成績について、C4591007 試験と C4591001 試験では異なる
COVID-19 の重症化リスク因子の定義11)を用いたため、両試験間での比較は行わなかったが、C4591007
試験の第Ⅱ/Ⅲ相パートにおける COVID-19 の重症化リスク因子を有する集団(54 例)及び有さない集団
(210 例)の中和抗体価(GMT[両側 95%CI])はそれぞれ 1,364.0[1,170.8, 1,589.1]及び 1,158.2[1,056.6,
1,269.6]であり、COVID-19 の重症化リスク因子の有無による中和抗体価への影響は認められなかった。
また、C4591007 試験第Ⅱ/Ⅲ相パートの 5~11 歳の小児におけるデルタ株に対する免疫原性を探索的
に評価した。デルタ株に対する本薬 2 回目接種 28 日後の中和抗体価(GMT[両側 95%CI])は、294.9
[214.6, 405.3]であり、参照株に対する中和抗体価 365.3[279.0, 478.4]よりも低かった。ただし、成人
での検討においても、本薬 2 回接種 28 日後の中和抗体価(GMT[両側 95%CI])は、デルタ株に対し
て 241.0[180.1, 322.4]、参照株に対して 310.1[203.3, 473.0]であり(コミナティ筋注
特例承認に係
る報告書(令和 3 年 11 月 2 日付け))、C4591007 試験での検討結果と同様の傾向であった。
また、C4591007 試験第Ⅱ/Ⅲ相パートでは、副次評価項目として COVID-19 確定例が少なくとも 21 例
集積された時点で VE に基づく COVID-19 発症予防効果を評価する計画とされていたが、本剤の米国で
の緊急使用許可について議論する FDA の Vaccines and Related Biological Products Advisory Committee
(VRBPAC)に 5~11 歳の小児における有効性に関するデータを提供する目的で、免疫ブリッジング解
析で成功基準が達成されたことを確認後に、事前に計画されていない VE の解析を行った。当該解析は
2021 年 10 月 8 日時点のカットオフデータに基づき、試験の実施に直接関与しない非盲検の統計担当者
及びプログラミング担当者12)により実施された。データカットオフ時点までに、有効性評価可能集団13)
において治験薬 2 回目接種後 7 日以降の COVID-19 確定例14)は 19 例(本薬群 3/1,450 例及びプラセボ群
各試験において、COVID-19 の重症化リスク因子として、それぞれ以下の基礎疾患又は肥満を定義した。
C4591007 試験 基礎疾患:喘息、血液疾患、心血管疾患、慢性肺疾患、慢性代謝性疾患、先天性心臓疾患、糖尿病、経管栄養者、
免疫不全状態、神経疾患、鎌状赤血球等、肥満:CDC growth chart(https://www.cdc.gov/growthcharts/html_charts/bmiagerev.htm(最終
確認日:2021 年 12 月 10 日)における BMI パーセンタイル値が 95 パーセンタイル以上
C4591001 試験 基礎疾患:Charlson Comorbidity Index に示される疾患、肥満:BMI 30 kg/m2 以上
12)
試験の実施に関与する盲検の統計担当者及びプログラミング担当者とは別の担当者
13)
無作為化された 2,285 例のうち、1 回目接種と 2 回目接種の間隔が規定する 19~42 日の範囲外の被験者(本薬群 31 例、プラセボ群
18 例)及び 2 回目接種後 7 日までに重大な治験実施計画書の逸脱の被験者(本薬群 47 例、プラセボ群 4 例)を除く、本薬群 1,450
例、プラセボ群 736 例が有効性評価可能集団とされた。
14)
COVID-19 が疑われる症状(発熱、新たな咳嗽又は咳嗽の悪化、新たな息切れ又は息切れの悪化、悪寒、新たな筋肉痛又は筋肉痛の
悪化、新たな味覚又は嗅覚の消失、咽喉痛、下痢、嘔吐)が 1 つ以上認められ、鼻腔スワブでの核酸増幅検査により SARS-CoV-2 陽
性が確認された者と定義された。
11)
13
コミナティ筋注 5~11 歳用_ファイザー株式会社_特例承認に係る報告書
20