よむ、つかう、まなぶ。
03 資料1_海外製インフルエンザワクチンの製造株選定に伴う薬事関係の具体的なスケジュール等について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37873.html |
| 出典情報 | 厚生科学審議会予防接種・ワクチン分科会研究開発及び生産・流通部会(第34回 2/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第31回厚生科学審議会予防接種・ワクチン分科会
資料1
第31回厚生科学審議会予防接種・ワクチン分科会研究開発
研 究 開 発 及 び 生 産 ・ 流 通 部 会
一部
改変
2023(令和5)年1月25日
及び生産・流通部会(令和5年1月25日開催)での検討内容
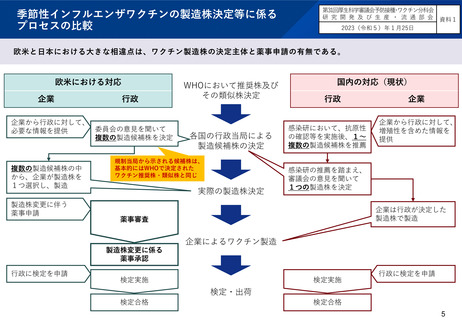
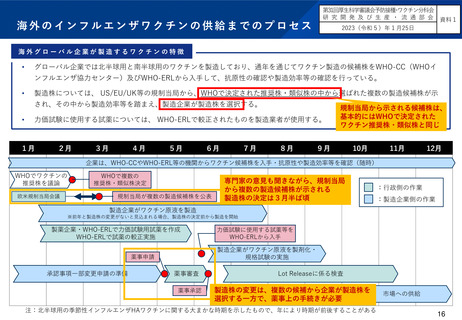
国内の既存の株選定スキームを存続させつつ、海外製のインフルエンザワクチンについては、WHOの推奨製造株の中から製造し
ていることを前提に、薬事申請を求めた上で、現状のように審議会(ワクチン製造株小委員会)での検討を経る必要がないこと
とした。また、既存のスキームと新設のスキームについて、ワクチンの製造企業の希望に応じて選択できることとした。
現状・課題
•
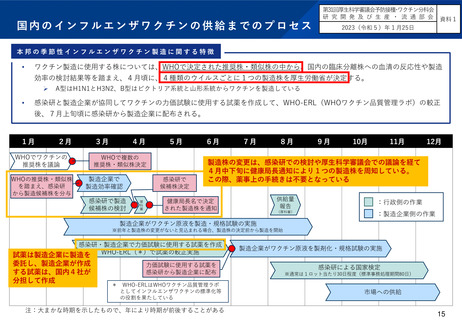
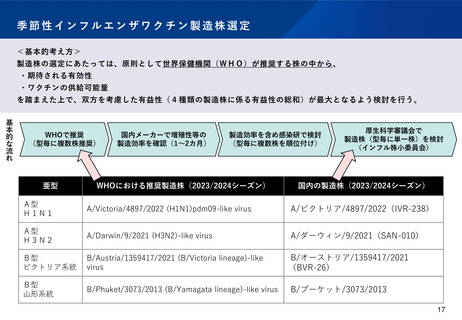
国内の既存のインフルエンザワクチンについては、WHOの推奨株(または類似株)の中から、感染研での検討を経て、厚生
労働省が4つのウイルスごとにワクチンの製造株を1つに決めている。また、ワクチンの製造株を行政が決定していること
などを踏まえ、製造株の変更については薬事承認が不要となっている。
•
現状の株選定スキームの下では、
➢
国内の4つの製造企業の間で品質のばらつきは少なく、また、製造企業で分担して国内での力価試験に使用する試薬を
受託製造していることから、製造企業側の負担も分散されているというメリットがある。
➢
一方、感染研において様々な検討を行っており、さらに厚生労働省でも審議会の意見を聴いていることから、製造株の
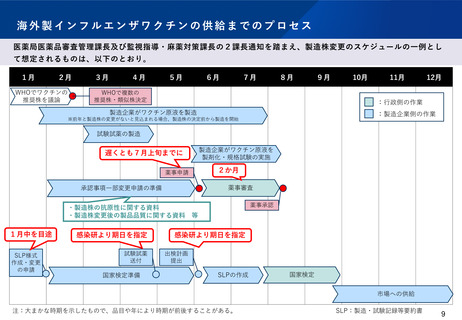
決定は例年4月中下旬となる側面もある(日本の製造株の決定は、海外企業におけるワクチン製造の開始には間に合っ
ていない)。
※前年からWHOの推奨株に変更がない亜型については、国内でも製造株を変更する可能性が低いことから、厚生労働省による製造株の
決定前に製造を開始している。
対
応
•
国内の既存のインフルエンザワクチンについて、均質なワクチンが提供され、現状のスキームには企業の負担が軽減されて
いるなどのメリットがあることから、既存の株選定スキームを存続させることとした(審議会等の取扱いもこれまでと同じ
取扱い)。
•
海外製のワクチンについては、WHOの推奨製造株(又は類似株)の中から製造していることを前提として、製造株の変更だ
けであっても海外と同様に薬事申請を求めるとともに、薬事審査の中で抗原性の変化の有無などの必要な情報を感染研でも
確認することとし、現状のように審議会(ワクチン製造株小委員会)での検討を経る必要がないこと(*)とした。
*海外製のワクチンの製造株の決定に当たって、感染研の協力を得て薬事審査の中で抗原性の変化の有無を確認する方針であり、製造
量を考慮しないのであれば、審議会で改めて製造株について議論する必要性は低い。
•
また、今後は既存の株選定スキームと海外製ワクチンで新たに設けるスキームについて、ワクチンの製造企業の希望に応じ
て選択できることとした。
4
資料1
第31回厚生科学審議会予防接種・ワクチン分科会研究開発
研 究 開 発 及 び 生 産 ・ 流 通 部 会
一部
改変
2023(令和5)年1月25日
及び生産・流通部会(令和5年1月25日開催)での検討内容
国内の既存の株選定スキームを存続させつつ、海外製のインフルエンザワクチンについては、WHOの推奨製造株の中から製造し
ていることを前提に、薬事申請を求めた上で、現状のように審議会(ワクチン製造株小委員会)での検討を経る必要がないこと
とした。また、既存のスキームと新設のスキームについて、ワクチンの製造企業の希望に応じて選択できることとした。
現状・課題
•
国内の既存のインフルエンザワクチンについては、WHOの推奨株(または類似株)の中から、感染研での検討を経て、厚生
労働省が4つのウイルスごとにワクチンの製造株を1つに決めている。また、ワクチンの製造株を行政が決定していること
などを踏まえ、製造株の変更については薬事承認が不要となっている。
•
現状の株選定スキームの下では、
➢
国内の4つの製造企業の間で品質のばらつきは少なく、また、製造企業で分担して国内での力価試験に使用する試薬を
受託製造していることから、製造企業側の負担も分散されているというメリットがある。
➢
一方、感染研において様々な検討を行っており、さらに厚生労働省でも審議会の意見を聴いていることから、製造株の
決定は例年4月中下旬となる側面もある(日本の製造株の決定は、海外企業におけるワクチン製造の開始には間に合っ
ていない)。
※前年からWHOの推奨株に変更がない亜型については、国内でも製造株を変更する可能性が低いことから、厚生労働省による製造株の
決定前に製造を開始している。
対
応
•
国内の既存のインフルエンザワクチンについて、均質なワクチンが提供され、現状のスキームには企業の負担が軽減されて
いるなどのメリットがあることから、既存の株選定スキームを存続させることとした(審議会等の取扱いもこれまでと同じ
取扱い)。
•
海外製のワクチンについては、WHOの推奨製造株(又は類似株)の中から製造していることを前提として、製造株の変更だ
けであっても海外と同様に薬事申請を求めるとともに、薬事審査の中で抗原性の変化の有無などの必要な情報を感染研でも
確認することとし、現状のように審議会(ワクチン製造株小委員会)での検討を経る必要がないこと(*)とした。
*海外製のワクチンの製造株の決定に当たって、感染研の協力を得て薬事審査の中で抗原性の変化の有無を確認する方針であり、製造
量を考慮しないのであれば、審議会で改めて製造株について議論する必要性は低い。
•
また、今後は既存の株選定スキームと海外製ワクチンで新たに設けるスキームについて、ワクチンの製造企業の希望に応じ
て選択できることとした。
4