よむ、つかう、まなぶ。
総ー4○令和6年度保険医療材料制度の見直しについて (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00240.html |
| 出典情報 | 中央社会保険医療協議会 総会(第579回 1/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
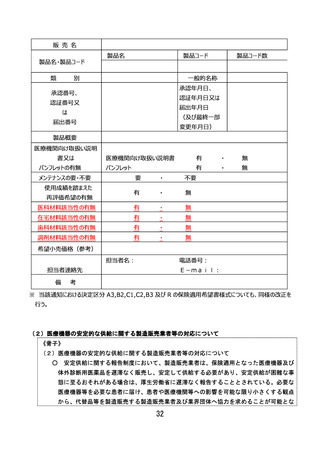
変更がなかった場合はそれらの項目について最新の情報が記載されている過去の薬事承認書、認証書又は
変更届書の写しを併せて提出すること。
ただし、既に保険適用されているプログラム医療機器においてアップデート等により有効性に影響する変更
があり、一部変更承認又は一部変更認証された場合、あるいは変更計画に従った変更を行う旨を届け出た
場合については、その「販売名」、「製品名・製品コード」、「使用目的又は効果」又は該当する機能区分等
に変更がない場合であっても、新たな有効性に基づき再評価を希望する場合には、決定区分A3(既存
技術・変更あり)、B2(既存機能区分・変更あり)、B3(期限付改良加算・暫定機能区分)、C
1(新機能)又はC2(新機能・新技術)の場合に準じて保険適用希望書を提出することができる。
※ このほか、プログラム医療機器の使用又は支給に係る保険外併用療養費制度の必要な見直しについて、中
医協総会の検討結果を踏まえ所要の改正を行う。
(2)外国価格調整について
ア
外国価格調整の比較水準について
《骨子》
ア 外国価格調整の比較水準について
○
新規収載品にかかる外国価格調整については、引き続き、
「外国価格の相加平均の 1.25
倍を上回る場合に 1.25 倍の価格」とする。
○
なお、以下のものについては、引き続き「外国価格の相加平均の 1.5 倍を上回る場合
に 1.5 倍の価格」とし、今後の実績を踏まえ対象については今後必要に応じて検討を行
う。
ⅰ)ニーズ検討会における検討結果を踏まえ厚生労働省が行った開発要請又は公募に応
じて開発されたもの(ニーズ検討会に係る評価を行う場合の要件を満たすものに限
る。
)
ⅱ)医薬品医療機器等法第77条の2第1項の規定に基づき、希少疾病用医療機器とし
て指定されたもの
ⅲ)医薬品医療機器等法第77条の2第2項の規定に基づき、先駆的医療機器として指
定されたもの
ⅳ)医薬品医療機器等法第77条の2第3項の規定に基づき、特定用途医療機器として
指定されたもの
ⅴ)画期性加算又は有用性加算(10%以上の補正加算を受けた医療材料に限る。)を受け、
新たに機能区分を設定したもの(原価計算方式で同様の要件を満たすものを含む。)
(改正事項なし)
20
変更届書の写しを併せて提出すること。
ただし、既に保険適用されているプログラム医療機器においてアップデート等により有効性に影響する変更
があり、一部変更承認又は一部変更認証された場合、あるいは変更計画に従った変更を行う旨を届け出た
場合については、その「販売名」、「製品名・製品コード」、「使用目的又は効果」又は該当する機能区分等
に変更がない場合であっても、新たな有効性に基づき再評価を希望する場合には、決定区分A3(既存
技術・変更あり)、B2(既存機能区分・変更あり)、B3(期限付改良加算・暫定機能区分)、C
1(新機能)又はC2(新機能・新技術)の場合に準じて保険適用希望書を提出することができる。
※ このほか、プログラム医療機器の使用又は支給に係る保険外併用療養費制度の必要な見直しについて、中
医協総会の検討結果を踏まえ所要の改正を行う。
(2)外国価格調整について
ア
外国価格調整の比較水準について
《骨子》
ア 外国価格調整の比較水準について
○
新規収載品にかかる外国価格調整については、引き続き、
「外国価格の相加平均の 1.25
倍を上回る場合に 1.25 倍の価格」とする。
○
なお、以下のものについては、引き続き「外国価格の相加平均の 1.5 倍を上回る場合
に 1.5 倍の価格」とし、今後の実績を踏まえ対象については今後必要に応じて検討を行
う。
ⅰ)ニーズ検討会における検討結果を踏まえ厚生労働省が行った開発要請又は公募に応
じて開発されたもの(ニーズ検討会に係る評価を行う場合の要件を満たすものに限
る。
)
ⅱ)医薬品医療機器等法第77条の2第1項の規定に基づき、希少疾病用医療機器とし
て指定されたもの
ⅲ)医薬品医療機器等法第77条の2第2項の規定に基づき、先駆的医療機器として指
定されたもの
ⅳ)医薬品医療機器等法第77条の2第3項の規定に基づき、特定用途医療機器として
指定されたもの
ⅴ)画期性加算又は有用性加算(10%以上の補正加算を受けた医療材料に限る。)を受け、
新たに機能区分を設定したもの(原価計算方式で同様の要件を満たすものを含む。)
(改正事項なし)
20