よむ、つかう、まなぶ。
○医薬品の新規薬価収載について 総-5-3 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00223.html |
| 出典情報 | 中央社会保険医療協議会 総会(第564回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
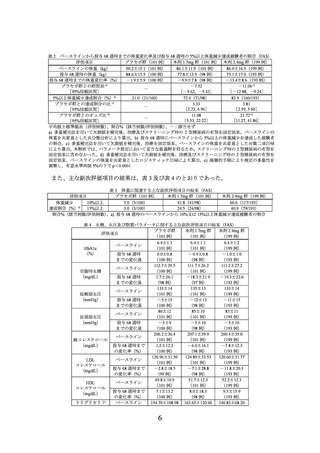
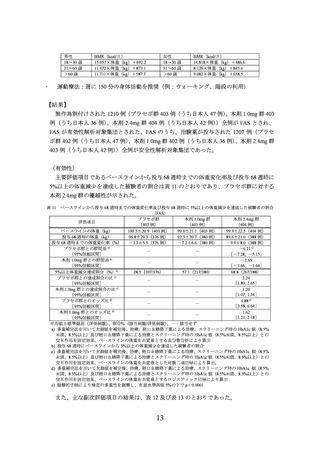
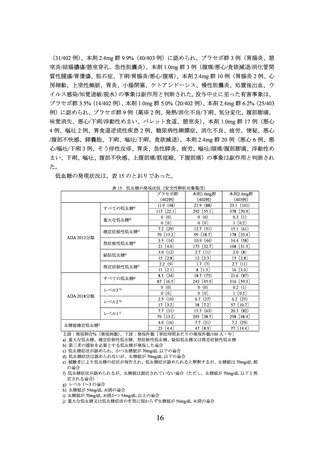
表 6 2 型糖尿病を有する部分集団における低血糖の発現状況(安全性解析対象集団)
プラセボ群
本剤1.7mg群
本剤2.4mg群
(25例)
(25例)
(49例)
0(0)
8.0(2)
16.3(8)
a)
すべての低血糖
0[0]
5[14.1]
19[27.8]
0(0)
0(0)
0(0)
b)
重大な低血糖
0[0]
0[0]
0[0]
0(0)
0(0)
4.1(2)
c)
確定症候性低血糖
0[0]
0[0]
3[4.4]
ADA 2013分類
0(0)
8.0(2)
6.1(3)
d)
無症候性低血糖
0[0]
5[14.1]
4[5.9]
0(0)
0(0)
8.2(4)
疑似低血糖e)
0[0]
0[0]
4[5.9]
0(0)
0(0)
8.2(4)
f)
推定症候性低血糖
0[0]
0[0]
8[11.7]
0(0)
8.0(2)
10.2(5)
すべての低血糖g)
0[0]
5[14.1]
7[10.3]
0(0)
0(0)
0(0)
b)
レベル3
0[0]
0[0]
0[0]
ADA 2018分類
0(0)
0(0)
0(0)
h)
レベル2
0[0]
0[0]
0[0]
0(0)
8.0(2)
10.2(5)
i)
レベル1
0[0]
5[14.1]
7[10.3]
0(0)
0(0)
0(0)
血糖値確定低血糖j)
0[0]
0[0]
0[0]
上段:発現割合%(発現例数)、下段:発現件数[単位時間あたりの発現件数/100 人・年]
a) 重大な低血糖、確定症候性低血糖、無症候性低血糖、疑似低血糖又は推定症候性低血糖
b) 第三者の援助を必要とする低血糖が発現した場合
c) 低血糖症状が認められ、かつ血糖値が 70mg/dL 以下の場合
d) 低血糖症状は認められないが、血糖値が 70mg/dL 以下の場合
e) 被験者により低血糖の症状が報告され、低血糖症が認められると解釈するが、血糖値は 70mg/dL 超の場合
f) 低血糖症状が認められるが、血糖値は測定されていない場合(ただし、血糖値が 70mg/dL 以下と推定される
場合)
g) レベル 1~3 の場合
h) 血糖値が 54mg/dL 未満の場合
i) 血糖値が 70mg/dL 未満かつ 54mg/dL 以上の場合
j) 重大な低血糖又は低血糖症状の有無に関わらず血糖値が 56mg/dL 未満の場合
注:2 型糖尿病を有さない被験者では、低血糖に関する有害事象は報告されなかった。
2.
肥満症等の被験者を対象とした国際共同第 III 相試験(4373 試験)
【試験の概要】
日本人を含む肥満症等の被験者(目標被験者数 1950 例(プラセボ群 650 例、本剤 2.4mg
群 1300 例)
)を対象に、食事療法及び運動療法施行下での本剤の有効性及び安全性を検討
するため、プラセボ対照無作為化二重盲検並行群間比較試験が実施された。
用法・用量は、プラセボ又は本剤 2.4mg を週 1 回、大腿部、腹部又は上腕部に皮下投与
(自己注射)とされた。本剤の開始用量は 0.25mg とされ、4 週間間隔で 0.5、1.0、1.7 及
び 2.4mg へ増量することとされた。なお、本剤 2.4mg に忍容性のない被験者は、本剤 1.7mg
で投与を継続することが可能とされた。
有効性の主要評価項目は、ベースラインから投与 68 週時までの体重変化率及び投与 68
週時に 5%以上の体重減少を達成した被験者の割合と設定された。
(主な選択基準)
8
プラセボ群
本剤1.7mg群
本剤2.4mg群
(25例)
(25例)
(49例)
0(0)
8.0(2)
16.3(8)
a)
すべての低血糖
0[0]
5[14.1]
19[27.8]
0(0)
0(0)
0(0)
b)
重大な低血糖
0[0]
0[0]
0[0]
0(0)
0(0)
4.1(2)
c)
確定症候性低血糖
0[0]
0[0]
3[4.4]
ADA 2013分類
0(0)
8.0(2)
6.1(3)
d)
無症候性低血糖
0[0]
5[14.1]
4[5.9]
0(0)
0(0)
8.2(4)
疑似低血糖e)
0[0]
0[0]
4[5.9]
0(0)
0(0)
8.2(4)
f)
推定症候性低血糖
0[0]
0[0]
8[11.7]
0(0)
8.0(2)
10.2(5)
すべての低血糖g)
0[0]
5[14.1]
7[10.3]
0(0)
0(0)
0(0)
b)
レベル3
0[0]
0[0]
0[0]
ADA 2018分類
0(0)
0(0)
0(0)
h)
レベル2
0[0]
0[0]
0[0]
0(0)
8.0(2)
10.2(5)
i)
レベル1
0[0]
5[14.1]
7[10.3]
0(0)
0(0)
0(0)
血糖値確定低血糖j)
0[0]
0[0]
0[0]
上段:発現割合%(発現例数)、下段:発現件数[単位時間あたりの発現件数/100 人・年]
a) 重大な低血糖、確定症候性低血糖、無症候性低血糖、疑似低血糖又は推定症候性低血糖
b) 第三者の援助を必要とする低血糖が発現した場合
c) 低血糖症状が認められ、かつ血糖値が 70mg/dL 以下の場合
d) 低血糖症状は認められないが、血糖値が 70mg/dL 以下の場合
e) 被験者により低血糖の症状が報告され、低血糖症が認められると解釈するが、血糖値は 70mg/dL 超の場合
f) 低血糖症状が認められるが、血糖値は測定されていない場合(ただし、血糖値が 70mg/dL 以下と推定される
場合)
g) レベル 1~3 の場合
h) 血糖値が 54mg/dL 未満の場合
i) 血糖値が 70mg/dL 未満かつ 54mg/dL 以上の場合
j) 重大な低血糖又は低血糖症状の有無に関わらず血糖値が 56mg/dL 未満の場合
注:2 型糖尿病を有さない被験者では、低血糖に関する有害事象は報告されなかった。
2.
肥満症等の被験者を対象とした国際共同第 III 相試験(4373 試験)
【試験の概要】
日本人を含む肥満症等の被験者(目標被験者数 1950 例(プラセボ群 650 例、本剤 2.4mg
群 1300 例)
)を対象に、食事療法及び運動療法施行下での本剤の有効性及び安全性を検討
するため、プラセボ対照無作為化二重盲検並行群間比較試験が実施された。
用法・用量は、プラセボ又は本剤 2.4mg を週 1 回、大腿部、腹部又は上腕部に皮下投与
(自己注射)とされた。本剤の開始用量は 0.25mg とされ、4 週間間隔で 0.5、1.0、1.7 及
び 2.4mg へ増量することとされた。なお、本剤 2.4mg に忍容性のない被験者は、本剤 1.7mg
で投与を継続することが可能とされた。
有効性の主要評価項目は、ベースラインから投与 68 週時までの体重変化率及び投与 68
週時に 5%以上の体重減少を達成した被験者の割合と設定された。
(主な選択基準)
8