よむ、つかう、まなぶ。
○医薬品の新規薬価収載について 総-5-3 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00223.html |
| 出典情報 | 中央社会保険医療協議会 総会(第564回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
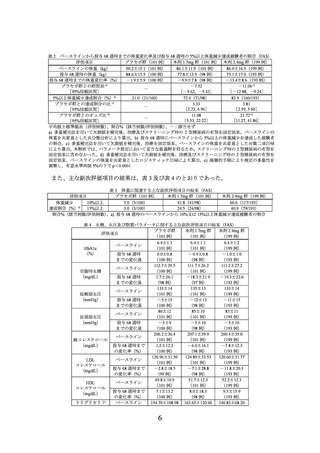
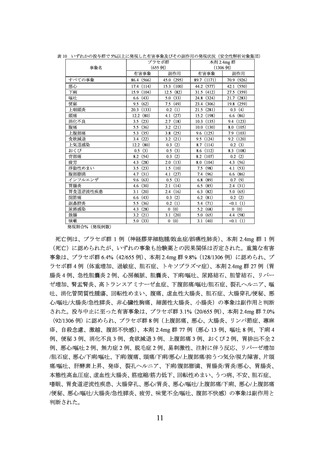
低血糖に関する有害事象は、
本剤 2.4mg 群で 8 例
(0.6%)
15 件、
プラセボ群で 5 例
(0.8%)
7 件報告された。
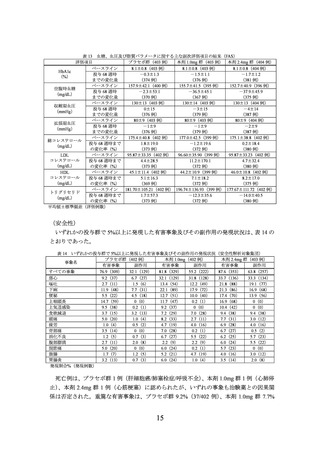
3.
2 型糖尿病を有する肥満症等の被験者を対象とした国際共同第 III 相試験(4374 試
験)
【試験の概要】
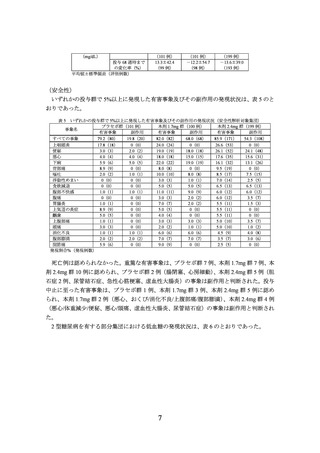
日本人を含む 2 型糖尿病を有する肥満症等の被験者(目標被験者数 1200 例(プラセボ
群、本剤 1.0mg 群、本剤 2.4mg 群:各 400 例)
)を対象に、食事療法及び運動療法施行下
での本剤の有効性及び安全性を検討するため、プラセボ対照無作為化二重盲検並行群間比
較試験が実施された。
用法・用量は、プラセボ、本剤 1.0mg 又は本剤 2.4mg を週 1 回、大腿部、腹部又は上腕
部に皮下投与(自己注射)とされた。本剤の開始用量は 0.25mg とされ、本剤 1.0mg 群で
は 4 週間間隔で 0.5 及び 1.0mg へ増量し、本剤 2.4mg 群では 4 週間間隔で 0.5、1.0、1.7 及
び 2.4mg へ増量することとされた。なお、本剤 1.0mg 群及び本剤 2.4mg 群のそれぞれにお
いて、本剤 1.0 又は 2.4mg に忍容性のない被験者は、より低用量で投与を継続することが
可能とされた。
有効性の主要評価項目は、ベースラインから投与 68 週時までの体重変化率及び投与 68
週時に 5%以上の体重減少を達成した被験者の割合と設定された。
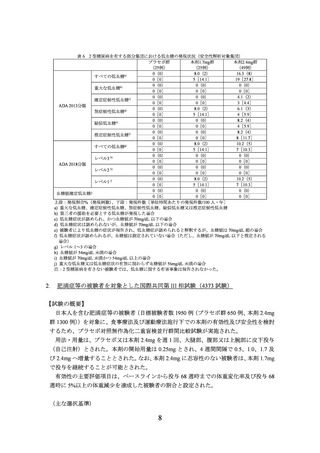
(主な選択基準)
18 歳以上(日本人は 20 歳以上)
BMI が 27.0 kg/m2 以上
スクリーニング時の 180 日以上前に 2 型糖尿病と診断され、HbA1c が 7.0~10.0%
なお、食事療法及び運動療法のみ実施中の患者の他、メトホルミン、SU 薬、SGLT2 阻
害薬又はチアゾリジン系薬剤を用いた 3 剤までの併用療法によりスクリーニング時の
90 日以上前から安定した治療を受けている患者は組入れ可能とされた。
体重減少のための食事療法を施行しても適切に管理できなかった治療歴を有する
試験期間中、患者には 4 週ごとに来院/電話コンタクトにて以下の食事・運動のカウンセ
リングが行われた。カウンセリングは糖尿病の状態を考慮した上で実施された。食事の内容
と身体活動については患者に毎日、日誌をつけることが推奨された。
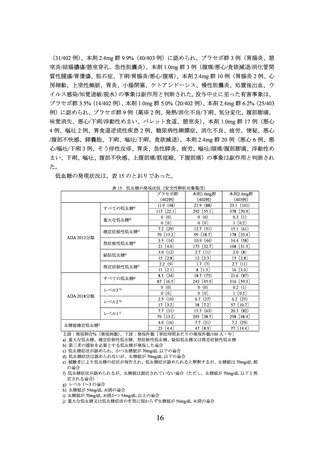
・ 食事療法:推定一日総エネルギー消費量(TEE)※1 から 500 kcal 差し引いたエネルギー
摂取量
※1 TEE=推定基礎代謝率(BMR)※2×1.3
※2 推定 BMR 値の計算式は以下のとおり
12
本剤 2.4mg 群で 8 例
(0.6%)
15 件、
プラセボ群で 5 例
(0.8%)
7 件報告された。
3.
2 型糖尿病を有する肥満症等の被験者を対象とした国際共同第 III 相試験(4374 試
験)
【試験の概要】
日本人を含む 2 型糖尿病を有する肥満症等の被験者(目標被験者数 1200 例(プラセボ
群、本剤 1.0mg 群、本剤 2.4mg 群:各 400 例)
)を対象に、食事療法及び運動療法施行下
での本剤の有効性及び安全性を検討するため、プラセボ対照無作為化二重盲検並行群間比
較試験が実施された。
用法・用量は、プラセボ、本剤 1.0mg 又は本剤 2.4mg を週 1 回、大腿部、腹部又は上腕
部に皮下投与(自己注射)とされた。本剤の開始用量は 0.25mg とされ、本剤 1.0mg 群で
は 4 週間間隔で 0.5 及び 1.0mg へ増量し、本剤 2.4mg 群では 4 週間間隔で 0.5、1.0、1.7 及
び 2.4mg へ増量することとされた。なお、本剤 1.0mg 群及び本剤 2.4mg 群のそれぞれにお
いて、本剤 1.0 又は 2.4mg に忍容性のない被験者は、より低用量で投与を継続することが
可能とされた。
有効性の主要評価項目は、ベースラインから投与 68 週時までの体重変化率及び投与 68
週時に 5%以上の体重減少を達成した被験者の割合と設定された。
(主な選択基準)
18 歳以上(日本人は 20 歳以上)
BMI が 27.0 kg/m2 以上
スクリーニング時の 180 日以上前に 2 型糖尿病と診断され、HbA1c が 7.0~10.0%
なお、食事療法及び運動療法のみ実施中の患者の他、メトホルミン、SU 薬、SGLT2 阻
害薬又はチアゾリジン系薬剤を用いた 3 剤までの併用療法によりスクリーニング時の
90 日以上前から安定した治療を受けている患者は組入れ可能とされた。
体重減少のための食事療法を施行しても適切に管理できなかった治療歴を有する
試験期間中、患者には 4 週ごとに来院/電話コンタクトにて以下の食事・運動のカウンセ
リングが行われた。カウンセリングは糖尿病の状態を考慮した上で実施された。食事の内容
と身体活動については患者に毎日、日誌をつけることが推奨された。
・ 食事療法:推定一日総エネルギー消費量(TEE)※1 から 500 kcal 差し引いたエネルギー
摂取量
※1 TEE=推定基礎代謝率(BMR)※2×1.3
※2 推定 BMR 値の計算式は以下のとおり
12