よむ、つかう、まなぶ。
資料1-4 アセトアミノフェンの添付文書 (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34324.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会 医薬品等安全対策部会 安全対策調査会(令和5年度第4回 7/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
れていないが、解熱剤としての有効性は視床下部の体温調節中枢
への作用に起因するとされ、鎮痛作用は視床と大脳皮質に作用し
て痛覚閾値を上昇させることによると考えられている。作用機序
としては、中枢神経系に作用し、プロスタグランジン(PG)合
成、カンナビノイド受容体系又はセロトニン作動系などに影響を
及ぼすと考えられている11)。
18.2 鎮痛作用
アセトアミノフェンの静脈内単回投与は、雄マウスを用いたフェ
ニルベンゾキノン腹腔内投与による侵害受容反応に対して鎮痛作
用を示した12)。
経胎盤移行が示されている(外国人データ)6)。
16.4 代謝
アセトアミノフェンの代謝は主に肝臓で行われ、主な代謝経路に
は、グルクロン酸抱合、硫酸抱合、チトクロムP450を介した酸
化的代謝経路の3つがある。チトクロムP450を介した酸化的代謝
経路では、主としてCYP2E1により反応性中間代謝物[N -アセ
チル-p -ベンゾキノンイミン(NAPQI)]が生成される。治療用
量では、NAPQIは迅速にグルタチオン抱合を受け、その後さら
に代謝されてシステイン及びメルカプツール酸との抱合体を形成
する7)。
16.5 排泄
アセトアミノフェン代謝物は主に尿中に排泄される。日本人成人
男性に本剤100mL(アセトアミノフェンとして1000mg)を投
与したとき、投与量の約80%が12時間以内に、90%以上が48時
間以内に尿中に排泄された。また、アセトアミノフェン未変化体
及び各代謝物の尿中累積排泄率は、経口製剤と同程度であっ
た3)。
19. 有効成分に関する理化学的知見
一般名:アセトアミノフェン(Acetaminophen)
化学名:N -(4-Hydroxyphenyl)acetamide
分子式:C8H9NO2
分子量:151.16
構造式:
OH
O
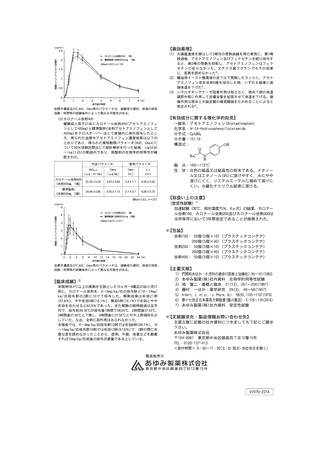
17.1 有効性及び安全性に関する試験
〈成人における疼痛〉
17.1.1 海外第Ⅲ相臨床試験
第三大臼歯抜歯後に中等度以上の疼痛を認めた患者152例を対象
として、本剤100mL(アセトアミノフェンとして1000mg)、プ
ロパセタモール注1)2000mg又はプラセボを単回投与(投与速度
100mL/15分)した。投与後0.25~6時間までの各評価時点にお
ける本剤投与群の痛みの改善度は、いずれの時点においても、プ
ラセボ投与群に比して有意な差が認められた(0.25~6時間の全
時点でp<0.001)
。
本剤投与群の有害事象発現率は27.5%(14/51例)で、主な有害
事象はめまい4例(7.8%)、遅延性の術後痛3例(5.9%)であっ
た8)。
〈小児における疼痛〉注2)
17.1.2 海外第Ⅲ相臨床試験
鼡径ヘルニア修復術を受け、術後に中等度以上の痛みを認めた小
児患者185例(1~12歳)を対象として、本剤1.5mL/kg(アセ
トアミノフェンとして15mg/kg)又はプロパセタモール 注1)
30mg/kgを15分かけて単回投与した。投与後0.25~6時間まで
の各評価時点において疼痛強度をVisual Analog Scale
(VAS)で評価し、ベースラインからの疼痛強度の差により鎮
痛効果を評価したところ、いずれの時点においても、本剤投与群
とプロパセタモール投与群で同程度の疼痛強度差が認められた。
本剤投与群の有害事象発現率は21.1%(20/95例)で、主な有害
事象は注入部位疼痛14例(14.7%)、嘔吐5例(5.3%)であっ
た9)。
〈小児における発熱〉注2)
17.1.3 海外第Ⅲ相臨床試験
感染症による急性発熱(直腸体温38.5~41℃)のある小児患者
(1カ月~12歳)67例を対象として、本剤1.5mL/kg(アセトア
ミノフェンとして15mg/kg)又はプロパセタモール注1)30mg/
kgを15分かけて単回投与した。投与後6時間の体温変化を評価し
たところ、ベースライン時の体温39.4℃に対し、本剤投与群の平
均最大体温低下は1.9℃であり、体温は投与後2時間で38℃以下
になり、そのままの状態を3.5時間維持した。
本剤投与群の有害事象発現率は14.3%(5/35例)で、主な有害
事象は局所の痛みもしくは反応2例(5.7%)、嘔吐1例(2.9%)
であった10)。
H 3C
性 状:白色の結晶又は結晶性の粉末である。メタノール又はエタ
ノール(95)に溶けやすく、水にやや溶けにくく、ジエチル
エーテルに極めて溶けにくい。水酸化ナトリウム試液に溶
ける。
20. 取扱い上の注意
20.1 凍結保存しないこと。
20.2 品質保持のため、外袋は使用時まで開封しないこと。
20.3 次の場合には使用しないこと。
・外袋が破損している場合
・外袋内や容器表面に水滴や結晶が認められる場合
・容器から薬液が漏れている場合
・性状その他薬液に異状が認められる場合
・ゴム栓部のシールがはがれている場合
22. 包装
100mL×20袋[脱酸素剤入り]
23. 主要文献
1)門間和夫ほか:小児科の進歩、診断と治療社.1983;2:
95-101
2)熊谷雄治:臨床医薬.2013;29(10):875-887
3)熊谷雄治:臨床医薬.2013;29(10):889-897
4)OFIRMEV添付文書
5)Gazzard BG et al.:J Pharm Pharmacol.1973;25:
964-967
6)Naga Rani MA et al.:J Indian Med Assoc.1989;
87(8):182-183
7)福本真理子:中毒研究.2003;16:285-297
8)Moller PL et al.:Anesthesia&Analgesia.2005;101
(1):90-96
9)Murat I et al.:Paediatr Anaesth.2005;15(8):663670
10)Duhamel JF et al.:Int J Clin Pharmacol Ther.
2007;45(4):221-229
11)鈴木孝浩:ペインクリニック.2012;33(2):218-226
12)テルモ株式会社:マウス薬理試験(社内資料)
24. 文献請求先及び問い合わせ先
注1)対照薬として用いられているプロパセタモールはアセトアミノフェン
のプロドラッグであり、血漿エステラーゼによって速やかにアセトアミノ
フェンとジエチルグリシンに変換される(プロパセタモール2000mgは約
1000mgのアセトアミノフェンに変換される)。国内未承認の医薬品であ
る。
注2)乳児及び2歳未満の幼児における用法・用量は以下のとおりである。
通常、乳児及び2歳未満の幼児にはアセトアミノフェンとして、体重1kgあ
たり1回7.5mgを15分かけて静脈内投与し、投与間隔は4~6時間以上とす
る。なお、年齢、症状により適宜増減するが、1日総量として30mg/kgを
限度とする。
テルモ・コールセンター
〒259-0151 神奈川県足柄上郡中井町井ノ口1500
TEL 0120-12-8195
26. 製造販売業者等
26.1 製造販売元
18. 薬効薬理
18.1 作用機序
アセトアミノフェンの作用の正確な部位や機序は完全には解明さ
AL08
NH
17. 臨床成績
- 4 -
への作用に起因するとされ、鎮痛作用は視床と大脳皮質に作用し
て痛覚閾値を上昇させることによると考えられている。作用機序
としては、中枢神経系に作用し、プロスタグランジン(PG)合
成、カンナビノイド受容体系又はセロトニン作動系などに影響を
及ぼすと考えられている11)。
18.2 鎮痛作用
アセトアミノフェンの静脈内単回投与は、雄マウスを用いたフェ
ニルベンゾキノン腹腔内投与による侵害受容反応に対して鎮痛作
用を示した12)。
経胎盤移行が示されている(外国人データ)6)。
16.4 代謝
アセトアミノフェンの代謝は主に肝臓で行われ、主な代謝経路に
は、グルクロン酸抱合、硫酸抱合、チトクロムP450を介した酸
化的代謝経路の3つがある。チトクロムP450を介した酸化的代謝
経路では、主としてCYP2E1により反応性中間代謝物[N -アセ
チル-p -ベンゾキノンイミン(NAPQI)]が生成される。治療用
量では、NAPQIは迅速にグルタチオン抱合を受け、その後さら
に代謝されてシステイン及びメルカプツール酸との抱合体を形成
する7)。
16.5 排泄
アセトアミノフェン代謝物は主に尿中に排泄される。日本人成人
男性に本剤100mL(アセトアミノフェンとして1000mg)を投
与したとき、投与量の約80%が12時間以内に、90%以上が48時
間以内に尿中に排泄された。また、アセトアミノフェン未変化体
及び各代謝物の尿中累積排泄率は、経口製剤と同程度であっ
た3)。
19. 有効成分に関する理化学的知見
一般名:アセトアミノフェン(Acetaminophen)
化学名:N -(4-Hydroxyphenyl)acetamide
分子式:C8H9NO2
分子量:151.16
構造式:
OH
O
17.1 有効性及び安全性に関する試験
〈成人における疼痛〉
17.1.1 海外第Ⅲ相臨床試験
第三大臼歯抜歯後に中等度以上の疼痛を認めた患者152例を対象
として、本剤100mL(アセトアミノフェンとして1000mg)、プ
ロパセタモール注1)2000mg又はプラセボを単回投与(投与速度
100mL/15分)した。投与後0.25~6時間までの各評価時点にお
ける本剤投与群の痛みの改善度は、いずれの時点においても、プ
ラセボ投与群に比して有意な差が認められた(0.25~6時間の全
時点でp<0.001)
。
本剤投与群の有害事象発現率は27.5%(14/51例)で、主な有害
事象はめまい4例(7.8%)、遅延性の術後痛3例(5.9%)であっ
た8)。
〈小児における疼痛〉注2)
17.1.2 海外第Ⅲ相臨床試験
鼡径ヘルニア修復術を受け、術後に中等度以上の痛みを認めた小
児患者185例(1~12歳)を対象として、本剤1.5mL/kg(アセ
トアミノフェンとして15mg/kg)又はプロパセタモール 注1)
30mg/kgを15分かけて単回投与した。投与後0.25~6時間まで
の各評価時点において疼痛強度をVisual Analog Scale
(VAS)で評価し、ベースラインからの疼痛強度の差により鎮
痛効果を評価したところ、いずれの時点においても、本剤投与群
とプロパセタモール投与群で同程度の疼痛強度差が認められた。
本剤投与群の有害事象発現率は21.1%(20/95例)で、主な有害
事象は注入部位疼痛14例(14.7%)、嘔吐5例(5.3%)であっ
た9)。
〈小児における発熱〉注2)
17.1.3 海外第Ⅲ相臨床試験
感染症による急性発熱(直腸体温38.5~41℃)のある小児患者
(1カ月~12歳)67例を対象として、本剤1.5mL/kg(アセトア
ミノフェンとして15mg/kg)又はプロパセタモール注1)30mg/
kgを15分かけて単回投与した。投与後6時間の体温変化を評価し
たところ、ベースライン時の体温39.4℃に対し、本剤投与群の平
均最大体温低下は1.9℃であり、体温は投与後2時間で38℃以下
になり、そのままの状態を3.5時間維持した。
本剤投与群の有害事象発現率は14.3%(5/35例)で、主な有害
事象は局所の痛みもしくは反応2例(5.7%)、嘔吐1例(2.9%)
であった10)。
H 3C
性 状:白色の結晶又は結晶性の粉末である。メタノール又はエタ
ノール(95)に溶けやすく、水にやや溶けにくく、ジエチル
エーテルに極めて溶けにくい。水酸化ナトリウム試液に溶
ける。
20. 取扱い上の注意
20.1 凍結保存しないこと。
20.2 品質保持のため、外袋は使用時まで開封しないこと。
20.3 次の場合には使用しないこと。
・外袋が破損している場合
・外袋内や容器表面に水滴や結晶が認められる場合
・容器から薬液が漏れている場合
・性状その他薬液に異状が認められる場合
・ゴム栓部のシールがはがれている場合
22. 包装
100mL×20袋[脱酸素剤入り]
23. 主要文献
1)門間和夫ほか:小児科の進歩、診断と治療社.1983;2:
95-101
2)熊谷雄治:臨床医薬.2013;29(10):875-887
3)熊谷雄治:臨床医薬.2013;29(10):889-897
4)OFIRMEV添付文書
5)Gazzard BG et al.:J Pharm Pharmacol.1973;25:
964-967
6)Naga Rani MA et al.:J Indian Med Assoc.1989;
87(8):182-183
7)福本真理子:中毒研究.2003;16:285-297
8)Moller PL et al.:Anesthesia&Analgesia.2005;101
(1):90-96
9)Murat I et al.:Paediatr Anaesth.2005;15(8):663670
10)Duhamel JF et al.:Int J Clin Pharmacol Ther.
2007;45(4):221-229
11)鈴木孝浩:ペインクリニック.2012;33(2):218-226
12)テルモ株式会社:マウス薬理試験(社内資料)
24. 文献請求先及び問い合わせ先
注1)対照薬として用いられているプロパセタモールはアセトアミノフェン
のプロドラッグであり、血漿エステラーゼによって速やかにアセトアミノ
フェンとジエチルグリシンに変換される(プロパセタモール2000mgは約
1000mgのアセトアミノフェンに変換される)。国内未承認の医薬品であ
る。
注2)乳児及び2歳未満の幼児における用法・用量は以下のとおりである。
通常、乳児及び2歳未満の幼児にはアセトアミノフェンとして、体重1kgあ
たり1回7.5mgを15分かけて静脈内投与し、投与間隔は4~6時間以上とす
る。なお、年齢、症状により適宜増減するが、1日総量として30mg/kgを
限度とする。
テルモ・コールセンター
〒259-0151 神奈川県足柄上郡中井町井ノ口1500
TEL 0120-12-8195
26. 製造販売業者等
26.1 製造販売元
18. 薬効薬理
18.1 作用機序
アセトアミノフェンの作用の正確な部位や機序は完全には解明さ
AL08
NH
17. 臨床成績
- 4 -