よむ、つかう、まなぶ。
薬-4別添○関係業界からの意見聴取について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00065.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第203回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
中医協 薬-4別添
5 . 7 . 5
別紙
再生医療等製品独自の制度導入までにご対応頂きたい喫緊の課題
2023 年 7 月 5 日 再生医療イノベーションフォーラム
再生医療等製品の製造から流通において、他のモダリティ医薬品と大きく異なる特徴が認
められている。独自の価格算定方式を実現するまでの期間、以下の点につき再生医療等製品
の価格算定にかかる緊急的な対応をお願いしたい。
1. 原価計算方式について
(背景)
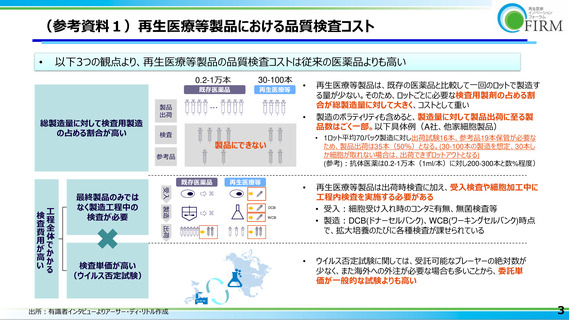
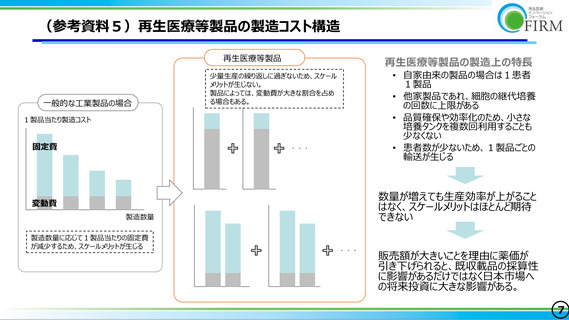
再生医療等製品は、細胞培養の継代上限や 1 患者 1 製品の結果少量生産であり、品質検
査の使用量が大きな割合を占め、かつ他のモダリティ医薬品と比較し検査費用が高額に
なる(検査回数が多く、検査単価も高い)という特徴があり(陳述資料 9、10 ページお
よび参考資料 1 参照)、他のモダリティ医薬品と比較して固有のコスト構造を有すること
が確認された(参考資料 2 参照)
。また、出発物質が患者細胞やドナー細胞といった生体
試料である場合、患者の前治療歴や容体、微生物汚染等の予期せぬ要因によって生体試
料が製造品質を満たさないロスが生じうる。各社製造効率を向上させる目的で細胞培養
のスケールアップを試みるも、その収率は期待値に及ばず逆に非効率になることが多い。
また、事例を積み重ねることで産業的な特徴も確認されてきた。現在上市されている再
生医療等製品はいずれもアカデミアやベンチャーを起源とし、あるステージ以降に製薬
企業が導入し上市に至っている。通常、両社間の契約においては事業評価の結果、ライ
センス料等の経済的合意を伴うものである。
これに対し、現行算定制度では、再生医療等製品の原価計算に積上げ不可とされる費用
が多く経験されている。
(提案)
原価計算方式において、再生医療等製品に特徴的なコスト構造に配慮した費用の取扱い
をご検討頂きたい。
2. 新薬創出等加算について
(背景)
薬価基準収載の再生医療等製品は、いずれも実勢価改定による薬価引下げが認められて
いない(参考資料 3 参照)
。価値に見合った取引価格の設定がされていることや、すべて
の企業が企業区分Ⅰとは限らないことに基づくと、再生医療等製品に対する新薬創出等
加算の平均加算率は極めて小さいと推測される(参考資料 4 参照)
。また再生医療は知財
面や技術面により、後発品の参入障壁が高い分野である。
(提案)
再生医療等製品については後発品が出ておらず、また後発品への速やかな置換え等の新
薬創出等加算のコンセプトがあっていないように思われる。現在の新薬創出等加算の実
績を踏まえ、再生医療等製品の新薬創出等加算関連制度は合理的な改善をご検討頂きた
い。
1
5 . 7 . 5
別紙
再生医療等製品独自の制度導入までにご対応頂きたい喫緊の課題
2023 年 7 月 5 日 再生医療イノベーションフォーラム
再生医療等製品の製造から流通において、他のモダリティ医薬品と大きく異なる特徴が認
められている。独自の価格算定方式を実現するまでの期間、以下の点につき再生医療等製品
の価格算定にかかる緊急的な対応をお願いしたい。
1. 原価計算方式について
(背景)
再生医療等製品は、細胞培養の継代上限や 1 患者 1 製品の結果少量生産であり、品質検
査の使用量が大きな割合を占め、かつ他のモダリティ医薬品と比較し検査費用が高額に
なる(検査回数が多く、検査単価も高い)という特徴があり(陳述資料 9、10 ページお
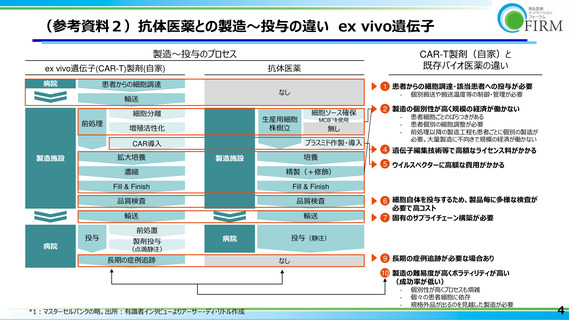
よび参考資料 1 参照)、他のモダリティ医薬品と比較して固有のコスト構造を有すること
が確認された(参考資料 2 参照)
。また、出発物質が患者細胞やドナー細胞といった生体
試料である場合、患者の前治療歴や容体、微生物汚染等の予期せぬ要因によって生体試
料が製造品質を満たさないロスが生じうる。各社製造効率を向上させる目的で細胞培養
のスケールアップを試みるも、その収率は期待値に及ばず逆に非効率になることが多い。
また、事例を積み重ねることで産業的な特徴も確認されてきた。現在上市されている再
生医療等製品はいずれもアカデミアやベンチャーを起源とし、あるステージ以降に製薬
企業が導入し上市に至っている。通常、両社間の契約においては事業評価の結果、ライ
センス料等の経済的合意を伴うものである。
これに対し、現行算定制度では、再生医療等製品の原価計算に積上げ不可とされる費用
が多く経験されている。
(提案)
原価計算方式において、再生医療等製品に特徴的なコスト構造に配慮した費用の取扱い
をご検討頂きたい。
2. 新薬創出等加算について
(背景)
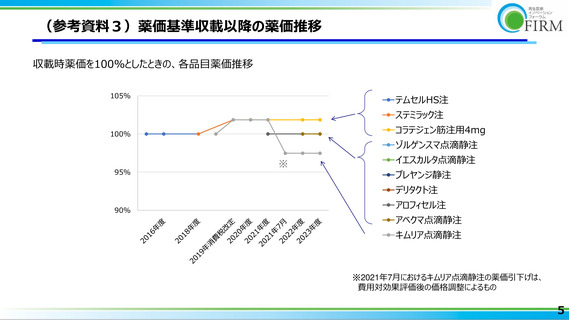
薬価基準収載の再生医療等製品は、いずれも実勢価改定による薬価引下げが認められて
いない(参考資料 3 参照)
。価値に見合った取引価格の設定がされていることや、すべて
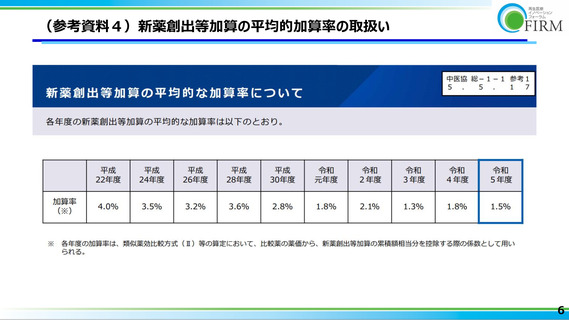
の企業が企業区分Ⅰとは限らないことに基づくと、再生医療等製品に対する新薬創出等
加算の平均加算率は極めて小さいと推測される(参考資料 4 参照)
。また再生医療は知財
面や技術面により、後発品の参入障壁が高い分野である。
(提案)
再生医療等製品については後発品が出ておらず、また後発品への速やかな置換え等の新
薬創出等加算のコンセプトがあっていないように思われる。現在の新薬創出等加算の実
績を踏まえ、再生医療等製品の新薬創出等加算関連制度は合理的な改善をご検討頂きた
い。
1