よむ、つかう、まなぶ。
薬-2別添○関係業界からの意見聴取について (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00065.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第203回 7/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2. 希少疾病加算:抗悪性腫瘍剤の効能追加時に適用されないケースの解消
課題認識:
希少疾病効能追加に基づく改定時加算(希少疾病加算)の適用に当たっては、「新たな
希少疾病用医薬品としての開発というよりも、従前効能の対象患者拡大に相当し、開発
リスクが低かったと考えられるもの」は加算の対象としないことが示されている。(『薬価
算定の基準』Q&A 問 107-7B)
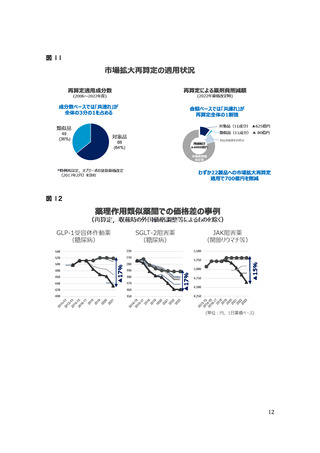
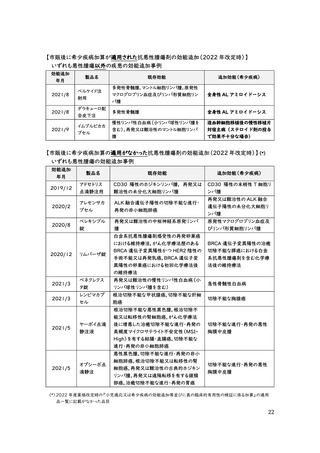
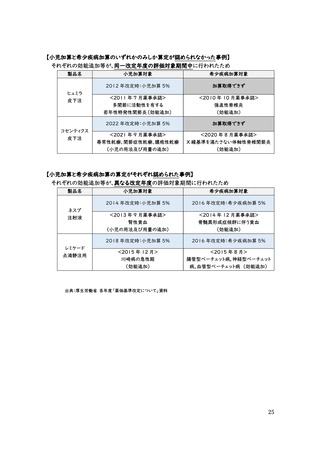
これに対し、近年の抗悪性腫瘍剤の効能追加事例(2022 年改定時の対象となる、
2019 年 11 月~2021 年 10 月の 2 年間)を見ると、市販後に希少疾病加算の適用
が認められたケースは 3 例とわずかであり、これらはいずれも悪性腫瘍以外の適応症に
対する効能追加である。一方、他の悪性腫瘍への効能追加を行ったケースではいずれも
市販後の希少疾病加算の適用がされていない。(次頁資料参照)
上記を踏まえるに、現実には、抗悪性腫瘍剤の他の悪性腫瘍への効能追加については、
個別製品の開発リスク等の程度は適切に評価されないまま、「免疫に作用する抗腫瘍薬
で対象範囲を拡大したものであり、開発リスクが低い」,「当該企業の負担が相当程度低
い」等として、ほぼ一律に希少疾病加算の適用外として取り扱われていると推測される。
しかしながら、当該加算が得られなかった製品の中には、作用機序の観点から、追加効
能開発の成功予見性が開発当初から乏しく、現実に追加効能の開発費用が初発効能の
開発費用を上回った製品も含まれている。
提案事項:
抗悪性腫瘍剤が希少疾病に該当する悪性腫瘍の効能追加を行った場合、市販後の
希少疾病加算の適用検討に当たっては、既存効能と追加効能の非類似性,追加効能
の開発リスク等を個別製品毎に十分に検討し、加算の適否が判断されるようにす
べき。
21
課題認識:
希少疾病効能追加に基づく改定時加算(希少疾病加算)の適用に当たっては、「新たな
希少疾病用医薬品としての開発というよりも、従前効能の対象患者拡大に相当し、開発
リスクが低かったと考えられるもの」は加算の対象としないことが示されている。(『薬価
算定の基準』Q&A 問 107-7B)
これに対し、近年の抗悪性腫瘍剤の効能追加事例(2022 年改定時の対象となる、
2019 年 11 月~2021 年 10 月の 2 年間)を見ると、市販後に希少疾病加算の適用
が認められたケースは 3 例とわずかであり、これらはいずれも悪性腫瘍以外の適応症に
対する効能追加である。一方、他の悪性腫瘍への効能追加を行ったケースではいずれも
市販後の希少疾病加算の適用がされていない。(次頁資料参照)
上記を踏まえるに、現実には、抗悪性腫瘍剤の他の悪性腫瘍への効能追加については、
個別製品の開発リスク等の程度は適切に評価されないまま、「免疫に作用する抗腫瘍薬
で対象範囲を拡大したものであり、開発リスクが低い」,「当該企業の負担が相当程度低
い」等として、ほぼ一律に希少疾病加算の適用外として取り扱われていると推測される。
しかしながら、当該加算が得られなかった製品の中には、作用機序の観点から、追加効
能開発の成功予見性が開発当初から乏しく、現実に追加効能の開発費用が初発効能の
開発費用を上回った製品も含まれている。
提案事項:
抗悪性腫瘍剤が希少疾病に該当する悪性腫瘍の効能追加を行った場合、市販後の
希少疾病加算の適用検討に当たっては、既存効能と追加効能の非類似性,追加効能
の開発リスク等を個別製品毎に十分に検討し、加算の適否が判断されるようにす
べき。
21