よむ、つかう、まなぶ。
緊急承認等された医薬品等の電子化された添付文書上での取扱いについて (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00012.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和4年度第2回 3/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
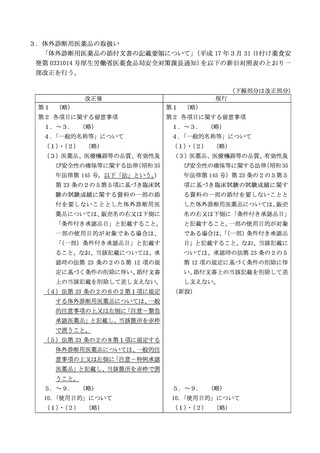
4.再生医療等製品の取扱い
「再生医療等製品の添付文書の記載要領(細則)について」(平成 26 年 10 月2日付け薬
食安発 1002 第 13 号厚生労働省医薬食品局安全対策課長通知の別紙を以下の新旧対照表
のとおり一部改正を行う。
(下線部分は改正部分)
改正後
現行
1. (略)
1. (略)
2.各記載項目に関する留意事項
2.各記載項目に関する留意事項
(1)・(2) (略)
(1)・(2) (略)
(3)「類別及び一般的名称等」について
(3)「類別及び一般的名称等」について
1)・2) (略)
1)・2) (略)
3)医薬品、医療機器等の品質、有効性及
3)医薬品、医療機器等の品質、有効性及
び安全性の確保等に関する法律
(昭和 35
び安全性の確保等に関する法律(昭和
年法律第 145 号。以下「法」という。)
35 年法律第 145 号)第 23 条の 26 第1
第 23 条の 26 第1項の条件及び期限付
項の条件及び期限付承認を受けた再生
承認を受けた再生医療等製品について
医療等製品については、販売名の右又は
は、販売名の右又は下側に「条件及び期
下側に「条件及び期限付承認品目」と記
限付承認品目」と記載すること。一部の
載すること。一部の効能、効果又は性能
効能、効果または性能が対象である場合
が対象である場合は、
「(一部)条件及び
は、「(一部)条件及び期限付承認品目」
期限付承認品目」と記載すること。なお、
と記載すること。なお、当該記載につい
当該記載については、条件及び期限付承
ては、条件及び期限付承認に対応する承
認に対応する承認条件を満たしたこと
認条件を満たしたことに伴い、添付文書
に伴い、添付文書上の当該記載を削除し
上の当該記載を削除して差し支えない。
て差し支えない。
4)法第 23 条の 26 の2第1項に規定する
(新設)
再生医療等製品については、販売名の上
又は左側に「注意-緊急承認再生医療等
製品」と記載し、当該箇所を赤枠で囲う
こと。
5)法第 23 条の 28 第1項に規定する再生
医療等製品については、販売名の上又は
左側に「注意-特例承認再生医療等製
品」と記載し、当該箇所を赤枠で囲うこ
と。
(4)~(7) (略)
(4)~(7) (略)
(8)「効能、効果又は性能」について
(8)「効能、効果又は性能」について
1)~3) (略)
1)~3)
(略)
4)効能、効果または性能の一部が、第 23
4)
「類別及び一般的名称等」に「(一部)
「再生医療等製品の添付文書の記載要領(細則)について」(平成 26 年 10 月2日付け薬
食安発 1002 第 13 号厚生労働省医薬食品局安全対策課長通知の別紙を以下の新旧対照表
のとおり一部改正を行う。
(下線部分は改正部分)
改正後
現行
1. (略)
1. (略)
2.各記載項目に関する留意事項
2.各記載項目に関する留意事項
(1)・(2) (略)
(1)・(2) (略)
(3)「類別及び一般的名称等」について
(3)「類別及び一般的名称等」について
1)・2) (略)
1)・2) (略)
3)医薬品、医療機器等の品質、有効性及
3)医薬品、医療機器等の品質、有効性及
び安全性の確保等に関する法律
(昭和 35
び安全性の確保等に関する法律(昭和
年法律第 145 号。以下「法」という。)
35 年法律第 145 号)第 23 条の 26 第1
第 23 条の 26 第1項の条件及び期限付
項の条件及び期限付承認を受けた再生
承認を受けた再生医療等製品について
医療等製品については、販売名の右又は
は、販売名の右又は下側に「条件及び期
下側に「条件及び期限付承認品目」と記
限付承認品目」と記載すること。一部の
載すること。一部の効能、効果又は性能
効能、効果または性能が対象である場合
が対象である場合は、
「(一部)条件及び
は、「(一部)条件及び期限付承認品目」
期限付承認品目」と記載すること。なお、
と記載すること。なお、当該記載につい
当該記載については、条件及び期限付承
ては、条件及び期限付承認に対応する承
認に対応する承認条件を満たしたこと
認条件を満たしたことに伴い、添付文書
に伴い、添付文書上の当該記載を削除し
上の当該記載を削除して差し支えない。
て差し支えない。
4)法第 23 条の 26 の2第1項に規定する
(新設)
再生医療等製品については、販売名の上
又は左側に「注意-緊急承認再生医療等
製品」と記載し、当該箇所を赤枠で囲う
こと。
5)法第 23 条の 28 第1項に規定する再生
医療等製品については、販売名の上又は
左側に「注意-特例承認再生医療等製
品」と記載し、当該箇所を赤枠で囲うこ
と。
(4)~(7) (略)
(4)~(7) (略)
(8)「効能、効果又は性能」について
(8)「効能、効果又は性能」について
1)~3) (略)
1)~3)
(略)
4)効能、効果または性能の一部が、第 23
4)
「類別及び一般的名称等」に「(一部)