よむ、つかう、まなぶ。
資料3:臨床研究法の見直しに係る各論点について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_23936.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第28回 2/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
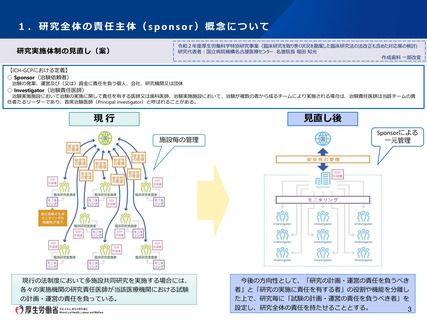
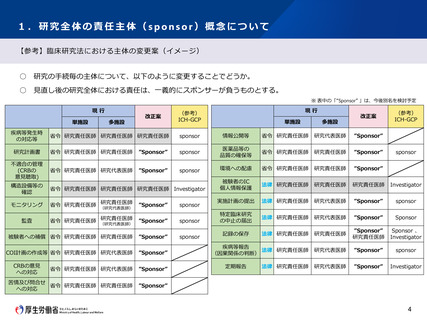
1.研究全体の責任主体(sponsor)概念について
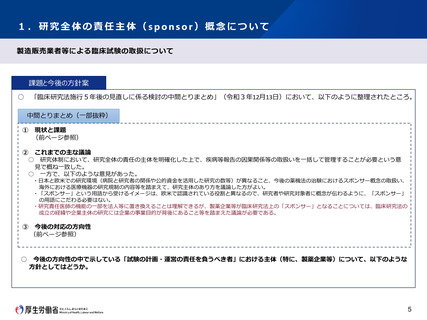
製造販売業者等による臨床試験の取扱における今後の方向性について
製造販売業者が行う臨床試験に係る状況
薬機法に基づく治験、再審査・再評価に係る製造販売後臨床試験等については、薬機法の規制下で実施されており、臨床研
究法における臨床研究の定義から除外されている。他方で、臨床研究法において、再審査・再評価に係る製造販売後臨床試
験以外の製造販売後の臨床試験(以下「再審査・再評価外製販後試験」という。)については、除外されていないため、特
定臨床研究の対象となっている。
特定臨床研究については、研究責任医師の責任の下で実施することとされており、企業等の法人の責任の下で実施すること
はできない。このため、再審査・再評価外製販後試験については、臨床研究法が施行された平成30年4月1日以降、企業が
試験参加医師に研究責任医師として実施するよう依頼する等の対応が採られてきた。
本来、企業等の法人が試験を実施しようとする場合は、企業等が自らの責任の下で実施すべきものであるが、それができな
い現状においては、グローバル企業が実施する国際共同試験に日本の参加ができなかったり、医師に依頼をする場合であっ
ても医師との間でプロトコルの調整等に時間がかかるといった課題がある。
検討の方向性
臨床研究法において企業の責任の下で実施する臨床研究の枠組みを設けることについては、「臨床研究法の成立の経緯や企
業主体の研究には企業の事業目的が背後にあること等を踏まえた議論が必要」といった意見が出たことも踏まえ、再審査・
再評価外製販後試験については、臨床研究法の対象としないこととしてはどうか。
仮に臨床研究法の対象としない場合には、再審査・再評価外製販後試験については、被験者の人権保護等の観点から、薬機
法下で別途適切な基準に準拠して実施する必要があるのではないか。
6
製造販売業者等による臨床試験の取扱における今後の方向性について
製造販売業者が行う臨床試験に係る状況
薬機法に基づく治験、再審査・再評価に係る製造販売後臨床試験等については、薬機法の規制下で実施されており、臨床研
究法における臨床研究の定義から除外されている。他方で、臨床研究法において、再審査・再評価に係る製造販売後臨床試
験以外の製造販売後の臨床試験(以下「再審査・再評価外製販後試験」という。)については、除外されていないため、特
定臨床研究の対象となっている。
特定臨床研究については、研究責任医師の責任の下で実施することとされており、企業等の法人の責任の下で実施すること
はできない。このため、再審査・再評価外製販後試験については、臨床研究法が施行された平成30年4月1日以降、企業が
試験参加医師に研究責任医師として実施するよう依頼する等の対応が採られてきた。
本来、企業等の法人が試験を実施しようとする場合は、企業等が自らの責任の下で実施すべきものであるが、それができな
い現状においては、グローバル企業が実施する国際共同試験に日本の参加ができなかったり、医師に依頼をする場合であっ
ても医師との間でプロトコルの調整等に時間がかかるといった課題がある。
検討の方向性
臨床研究法において企業の責任の下で実施する臨床研究の枠組みを設けることについては、「臨床研究法の成立の経緯や企
業主体の研究には企業の事業目的が背後にあること等を踏まえた議論が必要」といった意見が出たことも踏まえ、再審査・
再評価外製販後試験については、臨床研究法の対象としないこととしてはどうか。
仮に臨床研究法の対象としない場合には、再審査・再評価外製販後試験については、被験者の人権保護等の観点から、薬機
法下で別途適切な基準に準拠して実施する必要があるのではないか。
6