よむ、つかう、まなぶ。
資料3:臨床研究法の見直しに係る各論点について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_23936.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第28回 2/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
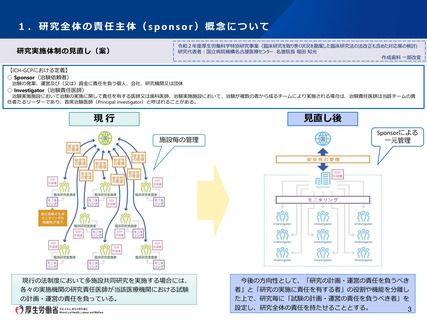
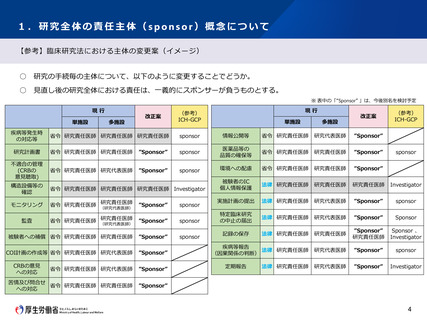
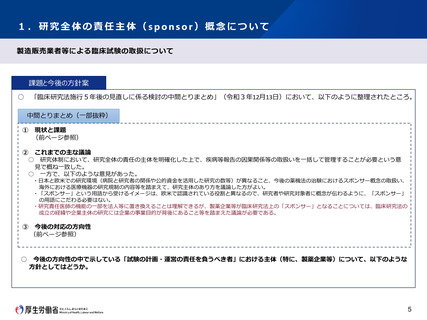
1.研究全体の責任主体(sponsor)概念について
研究実施体制の見直し(案)
令和2年度厚生労働科学特別研究事業(臨床研究を取り巻く状況を勘案した臨床研究法の法改正も含めた対応策の検討)
研究代表者:国立病院機構名古屋医療センター 名誉院長 堀田 知光
作成資料 一部改変
【ICH-GCPにおける定義】
○ Sponsor(治験依頼者)
治験の発案、運営及び(又は)資金に責任を負う個人、会社、研究機関又は団体
○ Investigator(治験責任医師)
治験実施施設において治験の実施に関して責任を有する医師又は歯科医師、治験実施施設において、治験が複数の者から成るチームにより実施される場合は、治験責任医師は当該チームの責
任者たるリーダーであり、首席治験医師(Principal investigator)と呼ばれることがある。
見直し後
現行
施設毎の管理
現行の法制度において多施設共同研究を実施する場合には、
各々の実施機関の研究責任医師が当該医療機関における試験
の計画・運営の責任を負っている。
Sponsorによる
一元管理
今後の方向性として、「研究の計画・運営の責任を負うべき
者」と「研究の実施に責任を有する者」の役割や機能を分離し
た上で、研究毎に「試験の計画・運営の責任を負うべき者」を
設定し、研究全体の責任を持たせることとする。
3
研究実施体制の見直し(案)
令和2年度厚生労働科学特別研究事業(臨床研究を取り巻く状況を勘案した臨床研究法の法改正も含めた対応策の検討)
研究代表者:国立病院機構名古屋医療センター 名誉院長 堀田 知光
作成資料 一部改変
【ICH-GCPにおける定義】
○ Sponsor(治験依頼者)
治験の発案、運営及び(又は)資金に責任を負う個人、会社、研究機関又は団体
○ Investigator(治験責任医師)
治験実施施設において治験の実施に関して責任を有する医師又は歯科医師、治験実施施設において、治験が複数の者から成るチームにより実施される場合は、治験責任医師は当該チームの責
任者たるリーダーであり、首席治験医師(Principal investigator)と呼ばれることがある。
見直し後
現行
施設毎の管理
現行の法制度において多施設共同研究を実施する場合には、
各々の実施機関の研究責任医師が当該医療機関における試験
の計画・運営の責任を負っている。
Sponsorによる
一元管理
今後の方向性として、「研究の計画・運営の責任を負うべき
者」と「研究の実施に責任を有する者」の役割や機能を分離し
た上で、研究毎に「試験の計画・運営の責任を負うべき者」を
設定し、研究全体の責任を持たせることとする。
3
関連画像
ページ内で利用されている画像ファイルです。
有料会員登録をして頂くことで、このページ内で利用されている画像を個別に閲覧・ダウンロードすることができるようになります。