よむ、つかう、まなぶ。
資料3:臨床研究法の見直しに係る各論点について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_23936.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第28回 2/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1.研究全体の責任主体(sponsor)概念について
課題と今後の方針案
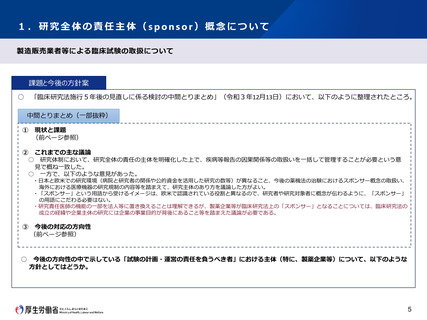
○ 「臨床研究法施行5年後の見直しに係る検討の中間とりまとめ」(令和3年12月13日)において、以下のように整理されたところ。
中間とりまとめ(一部抜粋)
① 現状と課題
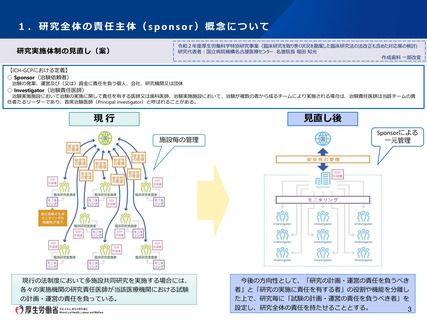
<現行の法制度>
多施設共同で実施する特定臨床研究では、実施医療機関毎に置かれた研究責任医師によりモニタリング、監査、疾病等報告等の諸手続が行
われている。
<課題>
○ 多施設共同研究の場合、同一研究内でも医療機関毎に監査等の手続の取扱いに差異が認められるといった指摘がある。
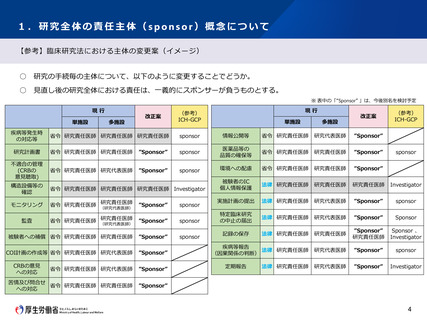
○ 一方、ICH-GCPにおいては、試験を計画・運営、資金確保を行う“sponsor”と、各施設での研究行為の実施責任を負う“investigator”がそれぞ
れ独立して存在しており、国際共同研究を円滑に実施する観点から、特定臨床研究にも、同様の「スポンサー」概念を導入すべきとの指摘
がある。
○ 臨床研究を実施する者としては(自然人たる)医師のみが想定されているが、法人としても実施できるようにすべきである。
② これまでの主な議論
○
研究体制において、研究全体の責任の主体を明確化した上で、疾病等報告の因果関係等の取扱いを一括して管理することが必要という意
見で概ね一致した。
○ 一方で、以下のような意見があった。
・日本と欧米での研究環境(病院と研究者の関係や公的資金を活用した研究の数等)が異なること、今後の薬機法の治験におけるスポンサー概念の取扱い、
海外における医療機器の研究規制の内容等を踏まえて、研究主体のあり方を議論した方がよい。
・「スポンサー」という用語から受けるイメージは、欧米で認識されている役割と異なるので、研究者や研究対象者に概念が伝わるように、「スポンサー」
の用語にこだわる必要はない。
・研究責任医師の機能の一部を法人等に置き換えることは理解できるが、製薬企業等が臨床研究法上の「スポンサー」となることについては、臨床研究法の
成立の経緯や企業主体の研究には企業の事業目的が背後にあること等を踏まえた議論が必要である。
③ 今後の対応の方向性
○
特に多施設共同研究において、「試験の計画・運営の責任を負うべき者」を位置づけ、監査、モニタリング、疾病等報告等の判断を一元
化する方向で見直しを進めるべきである。
○ その際には、責任や役割に応じたペナルティ等の整備も考慮に入れる必要がある。
○ 「試験の計画・運営の責任を負うべき者」について、その主体や日本の研究環境等におけるあり方、具体的な役割(他の研究関係者との
役割の整理)など、制度の詳細について引き続き検討を進める必要がある。
○ 今後の方向性の中で示している「試験の計画・運営の責任を負うべき者」の位置づけ、責任や役割について以下の方針としてはどうか。
2
課題と今後の方針案
○ 「臨床研究法施行5年後の見直しに係る検討の中間とりまとめ」(令和3年12月13日)において、以下のように整理されたところ。
中間とりまとめ(一部抜粋)
① 現状と課題
<現行の法制度>
多施設共同で実施する特定臨床研究では、実施医療機関毎に置かれた研究責任医師によりモニタリング、監査、疾病等報告等の諸手続が行
われている。
<課題>
○ 多施設共同研究の場合、同一研究内でも医療機関毎に監査等の手続の取扱いに差異が認められるといった指摘がある。
○ 一方、ICH-GCPにおいては、試験を計画・運営、資金確保を行う“sponsor”と、各施設での研究行為の実施責任を負う“investigator”がそれぞ
れ独立して存在しており、国際共同研究を円滑に実施する観点から、特定臨床研究にも、同様の「スポンサー」概念を導入すべきとの指摘
がある。
○ 臨床研究を実施する者としては(自然人たる)医師のみが想定されているが、法人としても実施できるようにすべきである。
② これまでの主な議論
○
研究体制において、研究全体の責任の主体を明確化した上で、疾病等報告の因果関係等の取扱いを一括して管理することが必要という意
見で概ね一致した。
○ 一方で、以下のような意見があった。
・日本と欧米での研究環境(病院と研究者の関係や公的資金を活用した研究の数等)が異なること、今後の薬機法の治験におけるスポンサー概念の取扱い、
海外における医療機器の研究規制の内容等を踏まえて、研究主体のあり方を議論した方がよい。
・「スポンサー」という用語から受けるイメージは、欧米で認識されている役割と異なるので、研究者や研究対象者に概念が伝わるように、「スポンサー」
の用語にこだわる必要はない。
・研究責任医師の機能の一部を法人等に置き換えることは理解できるが、製薬企業等が臨床研究法上の「スポンサー」となることについては、臨床研究法の
成立の経緯や企業主体の研究には企業の事業目的が背後にあること等を踏まえた議論が必要である。
③ 今後の対応の方向性
○
特に多施設共同研究において、「試験の計画・運営の責任を負うべき者」を位置づけ、監査、モニタリング、疾病等報告等の判断を一元
化する方向で見直しを進めるべきである。
○ その際には、責任や役割に応じたペナルティ等の整備も考慮に入れる必要がある。
○ 「試験の計画・運営の責任を負うべき者」について、その主体や日本の研究環境等におけるあり方、具体的な役割(他の研究関係者との
役割の整理)など、制度の詳細について引き続き検討を進める必要がある。
○ 今後の方向性の中で示している「試験の計画・運営の責任を負うべき者」の位置づけ、責任や役割について以下の方針としてはどうか。
2