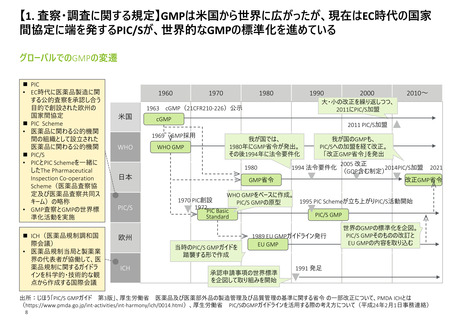
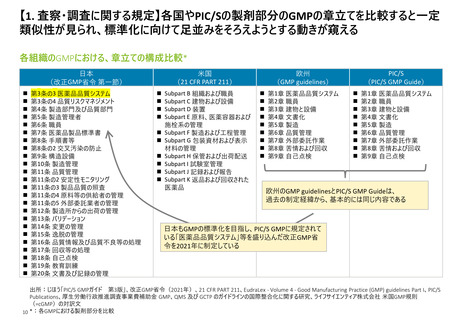
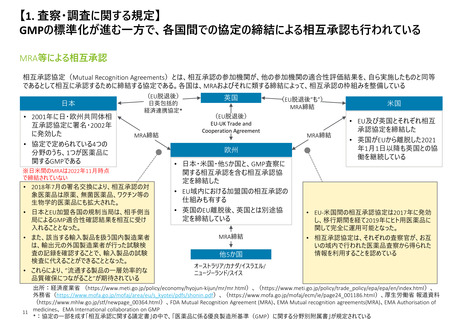
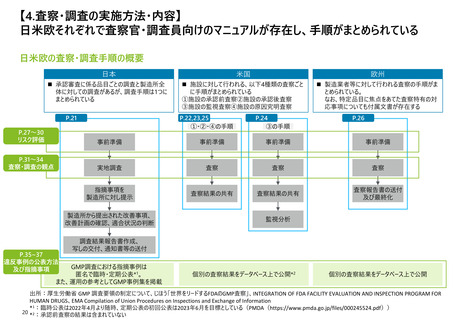
よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
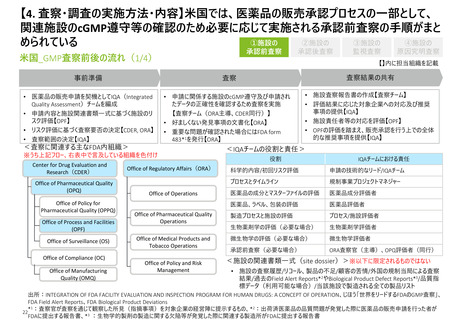
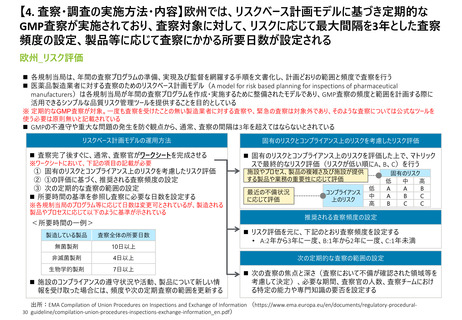
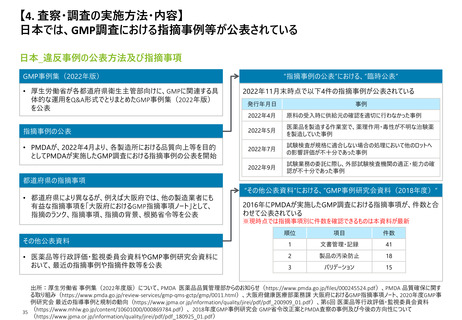
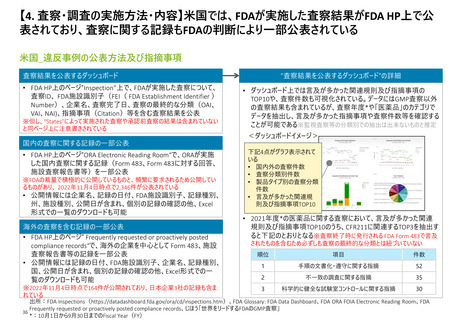
【3. 査察・調査の体制】日本と欧州は査察対象ごとに実施者が決まるが、米国は評価過
程で複数部署で分担して行う。なお、欧州は各加盟国の規制当局から集められた専門家
チームによって、査察が行われている模様である
一回当たりの査察・調査時のチーム体制
日本
米国
欧州
◼ 原則として1名以上の調査員及び必要に応じ
て関係する分野の専門家により調査チームを編
成する。
なお、専門性・経験の相互補完、調査実施
者の安全確保の観点から2名以上のチームとす
ることが望ましい*1
◼ 調査チームにはリーダー調査員の要件を満たす
ものを1名確保し、難しい場合は他の調査当
局から要件を満たす調査員を確保する*1
◼ Pre-Approval inspectionにおいてはOffice
of Regulatory Affairs(ORA:規制業務庁)
のメンバーが査察をリードし、Center for Drug
Evaluation Research(CDER:医薬品評価研
究センター)のメンバーも同行する*4
◼ Post-Approval inspection、Surveillance
inspection、For-cause inspectionにおいて
はORAのメンバーが査察をリードし、CDERのメン
バーは必要に応じて同行する*4
◼ 1名以上*9
※1名以上の査察官が査察を行う場合は、各メン
バーの役割を決めておくことが推奨されるとの記載
が手順書で示されており、詳細な役割分担につい
ての情報は現時点で取得できていない
◼ 調査当局として以下組織がそれぞれの調査対
象に対してGMPに係る調査を実施する*1・2
① PMDA
• 新医薬品、生物学的製剤、放射性医薬品等
を製造する国内製造所及び海外製造所
所掌業務
• その他医薬品を製造する海外製造所
② 47都道府県のGMP調査実施部局
• その他医薬品を製造する国内製造所
◼ 主に以下の部署が連携しながら、医薬品に関す
る施設評価と査察を実施する*5・6
① Center for Drug Evaluation
Research(CDER:医薬品評価研究センター)
• 医薬品の審査・承認
② Office of Regulatory Affairs(ORA:規制業
務庁)
• 規制対象となる米国内外の施設に対して査察
を実施
◼ 加盟国の規制当局(Competent
authorities)は査察によって、法的な要件が遵
守されていることを保証する*10
◼ 規制当局が他の加盟国と共有する専門家
(European experts)が、EMAのメンバーとして
働き、EMAに代わって査察を実施する*11・12
※各加盟国の、規制当局内部での所掌業務につ
いては不明
◼ CDER内の組織であるOffice of
Pharmaceutical Quality (OPQ) スタッフは
1,300名以上おり、ORAとともに多くの承認前
査察に参加している*7・8
※査察官の全体数は現時点で不明
◼ 50*注以上の各国規制当局から約4,000名の
expert(専門家)が輩出されており、EMAは専
門家の一覧を公開している*13
※GMP査察以外の担当も含まれていると推定
体制
人数
◼ 2018年4月時点でのGMP等立入調査に従事
する人数は462名であった*3
※PMDAと47都道府県の人数合計と推定
出所: *1厚生労働省 GMP 調査要領の制定について、 *2PMDA PIC/S加盟に向けたGMP調査当局の最近の取組について、 *3保健医療科学 第71巻第2号(2022.5)GMP 調
査の国際整合性確保と教育訓練について、*4INTEGRATION OF FDA FACILITY EVALUATION AND INSPECTION PROGRAM FOR HUMAN DRUGS: A CONCEPT OF OPERATION、
*5FDA Overview Organization Chart、*6じほう「世界をリードするFDAのGMP査察」、*7FDA Center for Drug Evaluation and Research Organization Chart、*8OPQ 2021 ANNUAL
REPORT、*9EMA Compilation of Union Procedures on Inspections and Exchange of Information、*10Directive 2001/83/EC、*11EMA National competent authorities
(human) 、*12European experts、*13European medicines regulatory network
注
17 * :欧州経済領域(EEA)加盟国のヒト用医薬品と動物用医薬品に関する規制当局の合計であり、単純な加盟国数とは異なる
程で複数部署で分担して行う。なお、欧州は各加盟国の規制当局から集められた専門家
チームによって、査察が行われている模様である
一回当たりの査察・調査時のチーム体制
日本
米国
欧州
◼ 原則として1名以上の調査員及び必要に応じ
て関係する分野の専門家により調査チームを編
成する。
なお、専門性・経験の相互補完、調査実施
者の安全確保の観点から2名以上のチームとす
ることが望ましい*1
◼ 調査チームにはリーダー調査員の要件を満たす
ものを1名確保し、難しい場合は他の調査当
局から要件を満たす調査員を確保する*1
◼ Pre-Approval inspectionにおいてはOffice
of Regulatory Affairs(ORA:規制業務庁)
のメンバーが査察をリードし、Center for Drug
Evaluation Research(CDER:医薬品評価研
究センター)のメンバーも同行する*4
◼ Post-Approval inspection、Surveillance
inspection、For-cause inspectionにおいて
はORAのメンバーが査察をリードし、CDERのメン
バーは必要に応じて同行する*4
◼ 1名以上*9
※1名以上の査察官が査察を行う場合は、各メン
バーの役割を決めておくことが推奨されるとの記載
が手順書で示されており、詳細な役割分担につい
ての情報は現時点で取得できていない
◼ 調査当局として以下組織がそれぞれの調査対
象に対してGMPに係る調査を実施する*1・2
① PMDA
• 新医薬品、生物学的製剤、放射性医薬品等
を製造する国内製造所及び海外製造所
所掌業務
• その他医薬品を製造する海外製造所
② 47都道府県のGMP調査実施部局
• その他医薬品を製造する国内製造所
◼ 主に以下の部署が連携しながら、医薬品に関す
る施設評価と査察を実施する*5・6
① Center for Drug Evaluation
Research(CDER:医薬品評価研究センター)
• 医薬品の審査・承認
② Office of Regulatory Affairs(ORA:規制業
務庁)
• 規制対象となる米国内外の施設に対して査察
を実施
◼ 加盟国の規制当局(Competent
authorities)は査察によって、法的な要件が遵
守されていることを保証する*10
◼ 規制当局が他の加盟国と共有する専門家
(European experts)が、EMAのメンバーとして
働き、EMAに代わって査察を実施する*11・12
※各加盟国の、規制当局内部での所掌業務につ
いては不明
◼ CDER内の組織であるOffice of
Pharmaceutical Quality (OPQ) スタッフは
1,300名以上おり、ORAとともに多くの承認前
査察に参加している*7・8
※査察官の全体数は現時点で不明
◼ 50*注以上の各国規制当局から約4,000名の
expert(専門家)が輩出されており、EMAは専
門家の一覧を公開している*13
※GMP査察以外の担当も含まれていると推定
体制
人数
◼ 2018年4月時点でのGMP等立入調査に従事
する人数は462名であった*3
※PMDAと47都道府県の人数合計と推定
出所: *1厚生労働省 GMP 調査要領の制定について、 *2PMDA PIC/S加盟に向けたGMP調査当局の最近の取組について、 *3保健医療科学 第71巻第2号(2022.5)GMP 調
査の国際整合性確保と教育訓練について、*4INTEGRATION OF FDA FACILITY EVALUATION AND INSPECTION PROGRAM FOR HUMAN DRUGS: A CONCEPT OF OPERATION、
*5FDA Overview Organization Chart、*6じほう「世界をリードするFDAのGMP査察」、*7FDA Center for Drug Evaluation and Research Organization Chart、*8OPQ 2021 ANNUAL
REPORT、*9EMA Compilation of Union Procedures on Inspections and Exchange of Information、*10Directive 2001/83/EC、*11EMA National competent authorities
(human) 、*12European experts、*13European medicines regulatory network
注
17 * :欧州経済領域(EEA)加盟国のヒト用医薬品と動物用医薬品に関する規制当局の合計であり、単純な加盟国数とは異なる