よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
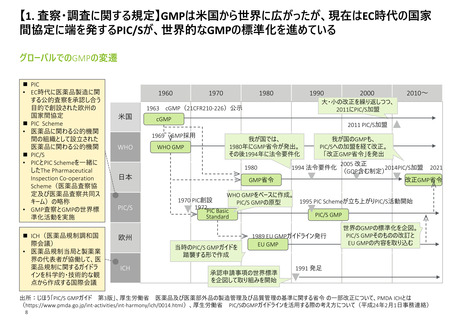
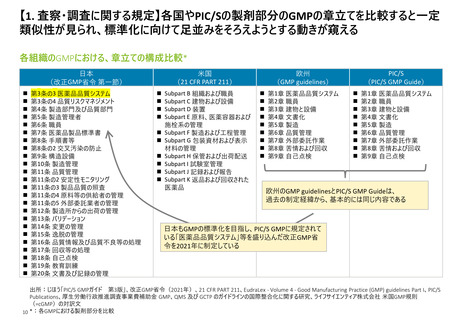
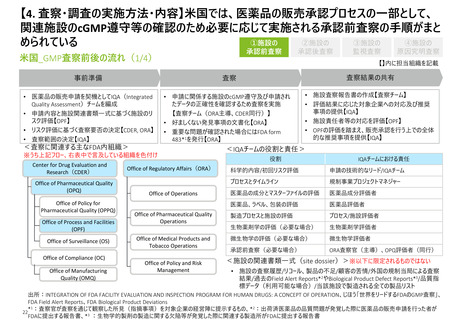
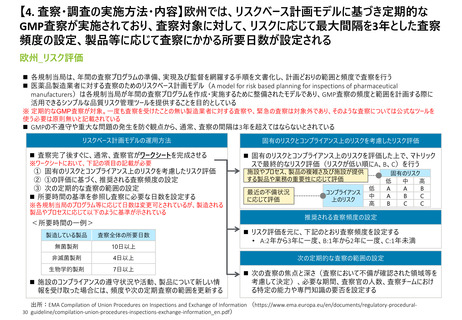
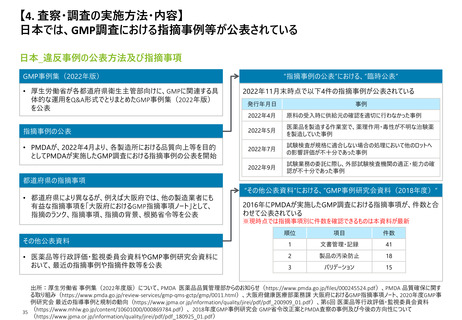
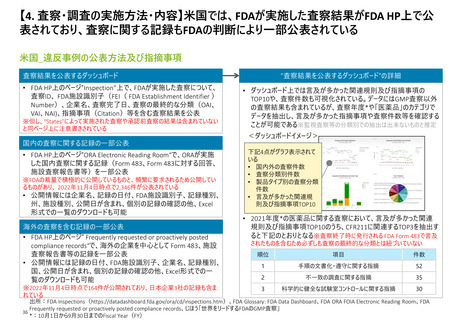
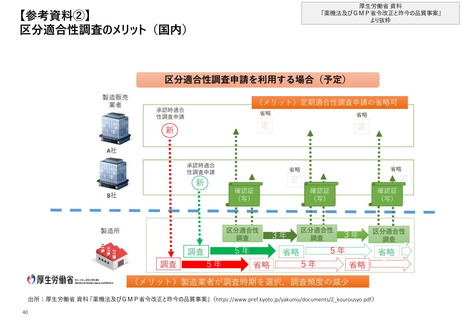
【1. 査察・調査に関する規定】各国やPIC/Sの製剤部分のGMPの章立てを比較すると一定
類似性が見られ、標準化に向けて足並みをそろえようとする動きが窺える
各組織のGMPにおける、章立ての構成比較*
日本
(改正GMP省令 第一節)
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
第3条の3 医薬品品質システム
第3条の4 品質リスクマネジメント
第4条 製造部門及び品質部門
第5条 製造管理者
第6条 職員
第7条 医薬品製品標準書
第8条 手順書等
第8条の2 交叉汚染の防止
第9条 構造設備
第10条 製造管理
第11条 品質管理
第11条の2 安定性モニタリング
第11条の3 製品品質の照査
第11条の4 原料等の供給者の管理
第11条の5 外部委託業者の管理
第12条 製造所からの出荷の管理
第13条 バリデーション
第14条 変更の管理
第15条 逸脱の管理
第16条 品質情報及び品質不良等の処理
第17条 回収等の処理
第18条 自己点検
第19条 教育訓練
第20条 文書及び記録の管理
米国
(21 CFR PART 211)
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
Subpart B 組織および職員
Subpart C 建物および設備
Subpart D 装置
Subpart E 原料、医薬容器および
施栓系の管理
Subpart F 製造および工程管理
Subpart G 包装資材および表示
材料の管理
Subpart H 保管および出荷配送
Subpart I 試験室管理
Subpart J 記録および報告
Subpart K 返品および回収された
医薬品
欧州
(GMP guidelines)
◼
◼
◼
◼
◼
◼
◼
◼
◼
第1章 医薬品品質システム
第2章 職員
第3章 建物と設備
第4章 文書化
第5章 製造
第6章 品質管理
第7章 外部委託作業
第8章 苦情および回収
第9章 自己点検
PIC/S
(PIC/S GMP Guide)
◼
◼
◼
◼
◼
◼
◼
◼
◼
第1章 医薬品品質システム
第2章 職員
第3章 建物と設備
第4章 文書化
第5章 製造
第6章 品質管理
第7章 外部委託作業
第8章 苦情および回収
第9章 自己点検
欧州のGMP guidelinesとPIC/S GMP Guideは、
過去の制定経緯から、基本的には同じ内容である
日本もGMPの標準化を目指し、PIC/S GMPに規定されて
いる「医薬品品質システム」等を盛り込んだ改正GMP省
令を2021年に制定している
出所:じほう「PIC/S GMPガイド 第3版」、改正GMP省令(2021年)、21 CFR PART 211、EudraLex - Volume 4 - Good Manufacturing Practice (GMP) guidelines Part I、PIC/S
Publications、厚生労働行政推進調査事業費補助金 GMP、QMS 及び GCTP のガイドラインの国際整合化に関する研究、ライフサイエンティア株式会社 米国GMP規則
(=cGMP)の対訳文
10 *:各GMPにおける製剤部分を比較
類似性が見られ、標準化に向けて足並みをそろえようとする動きが窺える
各組織のGMPにおける、章立ての構成比較*
日本
(改正GMP省令 第一節)
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
第3条の3 医薬品品質システム
第3条の4 品質リスクマネジメント
第4条 製造部門及び品質部門
第5条 製造管理者
第6条 職員
第7条 医薬品製品標準書
第8条 手順書等
第8条の2 交叉汚染の防止
第9条 構造設備
第10条 製造管理
第11条 品質管理
第11条の2 安定性モニタリング
第11条の3 製品品質の照査
第11条の4 原料等の供給者の管理
第11条の5 外部委託業者の管理
第12条 製造所からの出荷の管理
第13条 バリデーション
第14条 変更の管理
第15条 逸脱の管理
第16条 品質情報及び品質不良等の処理
第17条 回収等の処理
第18条 自己点検
第19条 教育訓練
第20条 文書及び記録の管理
米国
(21 CFR PART 211)
◼
◼
◼
◼
◼
◼
◼
◼
◼
◼
Subpart B 組織および職員
Subpart C 建物および設備
Subpart D 装置
Subpart E 原料、医薬容器および
施栓系の管理
Subpart F 製造および工程管理
Subpart G 包装資材および表示
材料の管理
Subpart H 保管および出荷配送
Subpart I 試験室管理
Subpart J 記録および報告
Subpart K 返品および回収された
医薬品
欧州
(GMP guidelines)
◼
◼
◼
◼
◼
◼
◼
◼
◼
第1章 医薬品品質システム
第2章 職員
第3章 建物と設備
第4章 文書化
第5章 製造
第6章 品質管理
第7章 外部委託作業
第8章 苦情および回収
第9章 自己点検
PIC/S
(PIC/S GMP Guide)
◼
◼
◼
◼
◼
◼
◼
◼
◼
第1章 医薬品品質システム
第2章 職員
第3章 建物と設備
第4章 文書化
第5章 製造
第6章 品質管理
第7章 外部委託作業
第8章 苦情および回収
第9章 自己点検
欧州のGMP guidelinesとPIC/S GMP Guideは、
過去の制定経緯から、基本的には同じ内容である
日本もGMPの標準化を目指し、PIC/S GMPに規定されて
いる「医薬品品質システム」等を盛り込んだ改正GMP省
令を2021年に制定している
出所:じほう「PIC/S GMPガイド 第3版」、改正GMP省令(2021年)、21 CFR PART 211、EudraLex - Volume 4 - Good Manufacturing Practice (GMP) guidelines Part I、PIC/S
Publications、厚生労働行政推進調査事業費補助金 GMP、QMS 及び GCTP のガイドラインの国際整合化に関する研究、ライフサイエンティア株式会社 米国GMP規則
(=cGMP)の対訳文
10 *:各GMPにおける製剤部分を比較