よむ、つかう、まなぶ。
医薬品・医療機器等安全性情報397号 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000083859.html |
| 出典情報 | 医薬品・医療機器等安全性情報397号(12/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
このうち,ブライトン分類評価がレベル3以上でアナフィラキシーと評価された症例は3例(うち重篤
3例)でした。なお,各社のロットごとの報告数については,アナフィラキシーが特定のロットに集中
しているということはありませんでした。
その他報告された症例も含め,令和4年7月に開催された合同会議で「ワクチンの安全性に新たな懸
念は認められない」と評価され,現時点では添付文書の改訂等の対応は必要なく,引き続き報告状況及
び報告内容に注視していくこととされました。
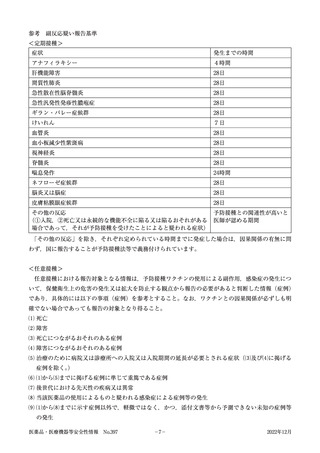
注1)症状名が「ギラン・バレー症候群」
「ADEM」として報告された症例。
注2)症状名が「アナフィラキシー反応」
,
「アナフィラキシーショック」
,
「アナフィラキシー様反応」又は「アナフィ
ラキシー様ショック」として報告された症例。
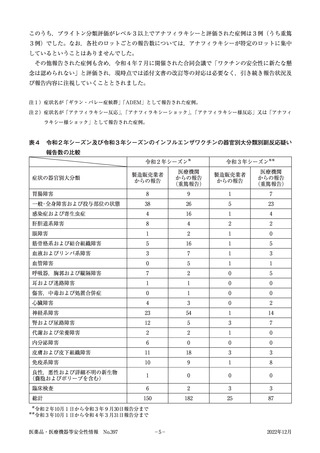
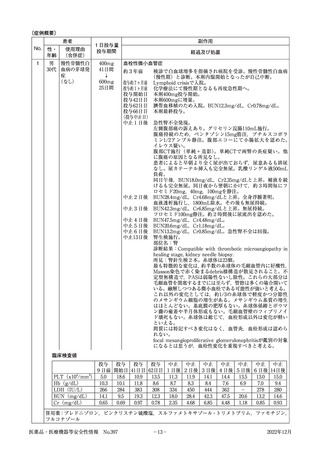
表4
令和2年シーズン及び令和3年シーズンのインフルエンザワクチンの器官別大分類別副反応疑い
報告数の比較
令和2年シーズン※
令和3年シーズン※※
製造販売業者
からの報告
医療機関
からの報告
(重篤報告)
製造販売業者
からの報告
医療機関
からの報告
(重篤報告)
胃腸障害
8
9
1
7
一般・全身障害および投与部位の状態
38
26
5
23
感染症および寄生虫症
4
16
1
4
肝胆道系障害
8
4
2
2
眼障害
1
2
1
0
筋骨格系および結合組織障害
5
16
1
5
血液およびリンパ系障害
3
7
1
3
血管障害
0
5
1
1
呼吸器,胸郭および縦隔障害
7
2
0
5
耳および迷路障害
1
1
0
0
傷害,中毒および処置合併症
0
1
0
0
心臓障害
4
3
0
2
神経系障害
23
54
1
14
腎および尿路障害
12
5
3
7
代謝および栄養障害
2
2
1
0
内分泌障害
6
0
0
0
皮膚および皮下組織障害
11
18
3
3
免疫系障害
10
9
1
8
1
0
0
0
6
2
3
3
150
182
25
87
症状の器官別大分類
良性,悪性および詳細不明の新生物
(嚢胞およびポリープを含む)
臨床検査
総計
※
※※
令和2年10月1日から令和3年9月30日報告分まで
令和3年10月1日から令和4年3月31日報告分まで
医薬品・医療機器等安全性情報
No.397
-5-
2022年12月
3例)でした。なお,各社のロットごとの報告数については,アナフィラキシーが特定のロットに集中
しているということはありませんでした。
その他報告された症例も含め,令和4年7月に開催された合同会議で「ワクチンの安全性に新たな懸
念は認められない」と評価され,現時点では添付文書の改訂等の対応は必要なく,引き続き報告状況及
び報告内容に注視していくこととされました。
注1)症状名が「ギラン・バレー症候群」
「ADEM」として報告された症例。
注2)症状名が「アナフィラキシー反応」
,
「アナフィラキシーショック」
,
「アナフィラキシー様反応」又は「アナフィ
ラキシー様ショック」として報告された症例。
表4
令和2年シーズン及び令和3年シーズンのインフルエンザワクチンの器官別大分類別副反応疑い
報告数の比較
令和2年シーズン※
令和3年シーズン※※
製造販売業者
からの報告
医療機関
からの報告
(重篤報告)
製造販売業者
からの報告
医療機関
からの報告
(重篤報告)
胃腸障害
8
9
1
7
一般・全身障害および投与部位の状態
38
26
5
23
感染症および寄生虫症
4
16
1
4
肝胆道系障害
8
4
2
2
眼障害
1
2
1
0
筋骨格系および結合組織障害
5
16
1
5
血液およびリンパ系障害
3
7
1
3
血管障害
0
5
1
1
呼吸器,胸郭および縦隔障害
7
2
0
5
耳および迷路障害
1
1
0
0
傷害,中毒および処置合併症
0
1
0
0
心臓障害
4
3
0
2
神経系障害
23
54
1
14
腎および尿路障害
12
5
3
7
代謝および栄養障害
2
2
1
0
内分泌障害
6
0
0
0
皮膚および皮下組織障害
11
18
3
3
免疫系障害
10
9
1
8
1
0
0
0
6
2
3
3
150
182
25
87
症状の器官別大分類
良性,悪性および詳細不明の新生物
(嚢胞およびポリープを含む)
臨床検査
総計
※
※※
令和2年10月1日から令和3年9月30日報告分まで
令和3年10月1日から令和4年3月31日報告分まで
医薬品・医療機器等安全性情報
No.397
-5-
2022年12月