よむ、つかう、まなぶ。
資料1-2 学会からの要望書【No.2021-2】 (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29581.html |
| 出典情報 | 医療ニーズの高い医療機器等の早期導入に関する検討会(第34回 12/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(別添様式1)
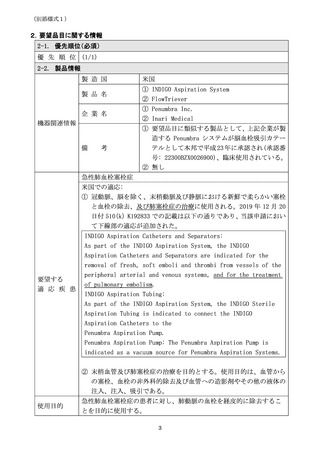
4.要望品目の臨床試験成績等に関する情報
4-1. 治験実施状況
① INDIGO Aspiration System
治験の実施
治験機器
要望品目と同一
治験実施国
米国
治験実施期間
2017 年 11 月 22 日~2019 年 4 月 5 日
治験デザイン
前向き多施設共同単群試験※
治験プロトコル
の概要
試験デザイン:
米国の最大 25 施設で最大 150 例の患者を登録する予定。急性
肺塞栓症は、臨床徴候及び臨床症状の持続期間が 14 日間以下
であり、CT 血管造影検査に基づく RV/LV 比が 0.9 超で、収縮期
血圧が 90 mmHg 以上と定義する。初回手技後 30 日間の追跡調
査を行う。
対象症例:
急性 PE の症状を呈し、その他の登録基準を満たす患者を本試
験の適格患者とみなす。
主要有効性評価項目:
CTA で評価した 48 時間後の RV/LV 比のベースライン時との比較
主要安全性評価項目:
48 時間以内のデバイス関連死
48 時間以内の大出血
48 時間以内のデバイス関連 SAE(臨床的増悪、肺血管損傷、心
臓損傷)
副次安全性評価項目
48 時間以内のデバイス関連死
48 時間以内の大出血
48 時間以内の臨床的増悪
48 時間以内の肺血管損傷
48 時間以内の心臓損傷
30 日以内の全死因死亡
30 日以内のデバイス関連 SAE
30 日以内の症候性 PE の再発
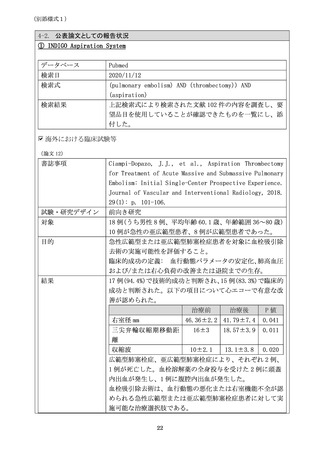
治験成績の概要
主要有効性評価項目は達成され、平均 RV/LV 比は 0.42
0.25 低
下した(低下率 26.9%)。主要安全性評価項目も達成され、主要有
害事象の複合の発現率は 1.7%であった。機器関連 SAE(0.8%)、臨
床状態の悪化(0.8%)及び大出血(1.7%)の発現率は低く、PE 再発は
認められなかった。
2021 年に文献発表された。文献 11 参照。
※
19
4.要望品目の臨床試験成績等に関する情報
4-1. 治験実施状況
① INDIGO Aspiration System
治験の実施
治験機器
要望品目と同一
治験実施国
米国
治験実施期間
2017 年 11 月 22 日~2019 年 4 月 5 日
治験デザイン
前向き多施設共同単群試験※
治験プロトコル
の概要
試験デザイン:
米国の最大 25 施設で最大 150 例の患者を登録する予定。急性
肺塞栓症は、臨床徴候及び臨床症状の持続期間が 14 日間以下
であり、CT 血管造影検査に基づく RV/LV 比が 0.9 超で、収縮期
血圧が 90 mmHg 以上と定義する。初回手技後 30 日間の追跡調
査を行う。
対象症例:
急性 PE の症状を呈し、その他の登録基準を満たす患者を本試
験の適格患者とみなす。
主要有効性評価項目:
CTA で評価した 48 時間後の RV/LV 比のベースライン時との比較
主要安全性評価項目:
48 時間以内のデバイス関連死
48 時間以内の大出血
48 時間以内のデバイス関連 SAE(臨床的増悪、肺血管損傷、心
臓損傷)
副次安全性評価項目
48 時間以内のデバイス関連死
48 時間以内の大出血
48 時間以内の臨床的増悪
48 時間以内の肺血管損傷
48 時間以内の心臓損傷
30 日以内の全死因死亡
30 日以内のデバイス関連 SAE
30 日以内の症候性 PE の再発
治験成績の概要
主要有効性評価項目は達成され、平均 RV/LV 比は 0.42
0.25 低
下した(低下率 26.9%)。主要安全性評価項目も達成され、主要有
害事象の複合の発現率は 1.7%であった。機器関連 SAE(0.8%)、臨
床状態の悪化(0.8%)及び大出血(1.7%)の発現率は低く、PE 再発は
認められなかった。
2021 年に文献発表された。文献 11 参照。
※
19