よむ、つかう、まなぶ。
○答申について-3-2 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00139.html |
| 出典情報 | 中央社会保険医療協議会 総会(第516回 2/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
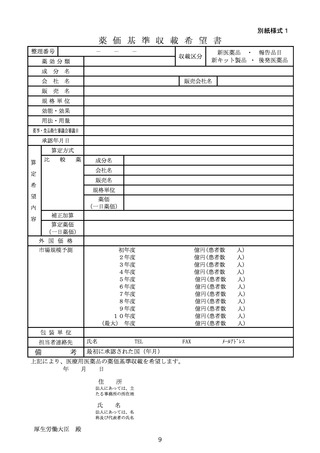
いう。以下同じ。)の薬価基準への収載手続は、後発医薬品の収載を希望す
る製造販売業者(以下「後発医薬品収載希望者」という。)が、別紙様式1
に定める薬価基準収載希望書を提出することにより行われるものであること。
なお、当該希望書は、原則として、2月 15 日及び8月 15 日(当該日が土
曜日又は日曜日に該当するときは、その日後においてその日に最も近い平日
とする。)までに医薬品医療機器等法に基づく承認を受けた当該後発医薬品
について、それぞれ当該年の3月 10 日及び9月 10 日までの指定する日まで
に提出すること。
④ 報告品目収載希望者、新キット収載希望者又は後発医薬品収載希望者から
の申し出により、薬価基準収載希望書の取り下げがあった場合には、再度、
薬価基準収載希望書を提出することを妨げない。ただし、この場合、薬価収
載希望書は、別に指定する期限までに提出すること。
(2) 薬価基準収載の時期等
① 報告品目及び新キット製品
5月及び 11 月を標準とする。
② 後発医薬品
6月及び 12 月を標準とする。
(3) 報告品目収載希望者、新キット製品収載希望者又は後発医薬品収載希望者
からの意見聴取
① 報告品目収載希望者又は新キット製品収載希望者からそれぞれ報告品目又
は新キット製品に係る薬価基準収載希望書の提出があった場合には、予め当
該報告品目収載希望者又は新キット製品収載希望者の意見を聴取する機会を
設ける。
この際の意見聴取の時期及び場所は、原則として、意見聴取実施予定日の
少なくとも1週間前に通知するものとすること。
② 後発医薬品収載希望者から後発医薬品に係る薬価基準収載希望書の提出が
あった場合には、必要に応じ当該収載希望者から意見を聴取する機会を設け
ることができる。
(4) 薬価収載の決定の通知
薬価基準収載希望書の提出があった場合には、当該希望書の内容を審査のう
え、薬価基準収載日から3ヶ月以内の供給開始及びその後の継続した安定供給
に支障がないことが確認された場合に限り、予め次の事項を報告品目収載希望
者、新キット収載希望者又は後発医薬品収載希望者に対し通知したうえで、薬
価基準に収載する。
① 品名、規格単位、決定された薬価
② 薬価収載予定日
③ 保険適用上の取扱い(特に必要な品目に限る。)
5
る製造販売業者(以下「後発医薬品収載希望者」という。)が、別紙様式1
に定める薬価基準収載希望書を提出することにより行われるものであること。
なお、当該希望書は、原則として、2月 15 日及び8月 15 日(当該日が土
曜日又は日曜日に該当するときは、その日後においてその日に最も近い平日
とする。)までに医薬品医療機器等法に基づく承認を受けた当該後発医薬品
について、それぞれ当該年の3月 10 日及び9月 10 日までの指定する日まで
に提出すること。
④ 報告品目収載希望者、新キット収載希望者又は後発医薬品収載希望者から
の申し出により、薬価基準収載希望書の取り下げがあった場合には、再度、
薬価基準収載希望書を提出することを妨げない。ただし、この場合、薬価収
載希望書は、別に指定する期限までに提出すること。
(2) 薬価基準収載の時期等
① 報告品目及び新キット製品
5月及び 11 月を標準とする。
② 後発医薬品
6月及び 12 月を標準とする。
(3) 報告品目収載希望者、新キット製品収載希望者又は後発医薬品収載希望者
からの意見聴取
① 報告品目収載希望者又は新キット製品収載希望者からそれぞれ報告品目又
は新キット製品に係る薬価基準収載希望書の提出があった場合には、予め当
該報告品目収載希望者又は新キット製品収載希望者の意見を聴取する機会を
設ける。
この際の意見聴取の時期及び場所は、原則として、意見聴取実施予定日の
少なくとも1週間前に通知するものとすること。
② 後発医薬品収載希望者から後発医薬品に係る薬価基準収載希望書の提出が
あった場合には、必要に応じ当該収載希望者から意見を聴取する機会を設け
ることができる。
(4) 薬価収載の決定の通知
薬価基準収載希望書の提出があった場合には、当該希望書の内容を審査のう
え、薬価基準収載日から3ヶ月以内の供給開始及びその後の継続した安定供給
に支障がないことが確認された場合に限り、予め次の事項を報告品目収載希望
者、新キット収載希望者又は後発医薬品収載希望者に対し通知したうえで、薬
価基準に収載する。
① 品名、規格単位、決定された薬価
② 薬価収載予定日
③ 保険適用上の取扱い(特に必要な品目に限る。)
5