よむ、つかう、まなぶ。
参考資料3:体外診断用医薬品の製造販売承認申請について(平成28年2月22日付け薬生発0222第5号厚生労働省医薬・生活衛生局長通知) (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29413.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第8回 11/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
臣が基準を定めて指定する体外診断用医薬品を除き、申請に係る体外診断
用医薬品の使用目的、形状・構造・原理、品目仕様、使用方法等に関する所
要の審査を行った上で、厚生労働大臣が品目ごとにその承認を与えること
とされており、承認申請に当たっては、その時点における医学、薬学等の
学問水準に基づき、倫理性、科学性及び信頼性の確保された資料により、
申請に係る体外診断用医薬品の品質、有効性及び安全性を立証するための
十分な根拠が示される必要がある。
2
この通知において用いる用語は以下のとおりとする。
(1)
「施行規則」とは、改正省令の規定による改正後の「医薬品、医療機器等
の品質、有効性及び安全性の確保等に関する法律施行規則」(昭和 36 年厚
生省令第1号)を指すものである。また、
「基本要件基準」とは、
「医薬品、
医療機器等の品質、有効性及び安全性の確保等に関する法律第 41 条第3項
の規定に基づき厚生労働大臣が定める体外診断用医薬品の基準」(平成 17
年厚生労働省告示第 126 号)をいう。
(2)
「新規項目」とは、検出又は測定しようとする対象物質又は項目が我が国
においてこれまでに承認若しくは認証された体外診断用医薬品によって検
出又は測定されたことがないものをいう。
(3)「承認基準」とは、「体外診断用医薬品の承認基準について」(平成 27 年
1月 20 日付け薬食発 0120 第1号厚生労働省医薬食品局長通知)により定
める基準への適合性を確認することにより承認審査を行う体外診断用医薬
品に関する基準をいう。
第2
製造販売承認申請の区分
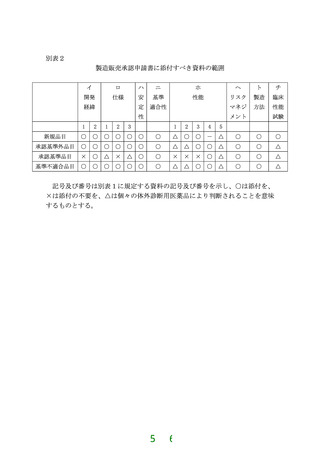
体外診断用医薬品の製造販売承認申請区分は次のとおりとする。なお、各申
請区分における製造販売承認申請書に添付すべき資料と添付資料の項目との関
係については別表1、製造販売承認申請書に添付すべき資料の範囲に関しては
別表2に示すとおりとする。
(1)新規品目
新規項目を検出又は測定しようとする品目。
(2)承認基準外品目
承認基準の定めのない品目。
(3)承認基準品目
承認基準の定めのある品目であって、承認基準に適合するもの。
「体外診断用医薬品の一般用検査薬への転用について」
(平成 26 年 12 月
25 日付け薬食発 1225 第1号厚生労働省医薬食品局長通知)に従って策定さ
れたガイドラインに基づき承認申請された一般用検査薬であって、承認基
2 / 6
用医薬品の使用目的、形状・構造・原理、品目仕様、使用方法等に関する所
要の審査を行った上で、厚生労働大臣が品目ごとにその承認を与えること
とされており、承認申請に当たっては、その時点における医学、薬学等の
学問水準に基づき、倫理性、科学性及び信頼性の確保された資料により、
申請に係る体外診断用医薬品の品質、有効性及び安全性を立証するための
十分な根拠が示される必要がある。
2
この通知において用いる用語は以下のとおりとする。
(1)
「施行規則」とは、改正省令の規定による改正後の「医薬品、医療機器等
の品質、有効性及び安全性の確保等に関する法律施行規則」(昭和 36 年厚
生省令第1号)を指すものである。また、
「基本要件基準」とは、
「医薬品、
医療機器等の品質、有効性及び安全性の確保等に関する法律第 41 条第3項
の規定に基づき厚生労働大臣が定める体外診断用医薬品の基準」(平成 17
年厚生労働省告示第 126 号)をいう。
(2)
「新規項目」とは、検出又は測定しようとする対象物質又は項目が我が国
においてこれまでに承認若しくは認証された体外診断用医薬品によって検
出又は測定されたことがないものをいう。
(3)「承認基準」とは、「体外診断用医薬品の承認基準について」(平成 27 年
1月 20 日付け薬食発 0120 第1号厚生労働省医薬食品局長通知)により定
める基準への適合性を確認することにより承認審査を行う体外診断用医薬
品に関する基準をいう。
第2
製造販売承認申請の区分
体外診断用医薬品の製造販売承認申請区分は次のとおりとする。なお、各申
請区分における製造販売承認申請書に添付すべき資料と添付資料の項目との関
係については別表1、製造販売承認申請書に添付すべき資料の範囲に関しては
別表2に示すとおりとする。
(1)新規品目
新規項目を検出又は測定しようとする品目。
(2)承認基準外品目
承認基準の定めのない品目。
(3)承認基準品目
承認基準の定めのある品目であって、承認基準に適合するもの。
「体外診断用医薬品の一般用検査薬への転用について」
(平成 26 年 12 月
25 日付け薬食発 1225 第1号厚生労働省医薬食品局長通知)に従って策定さ
れたガイドラインに基づき承認申請された一般用検査薬であって、承認基
2 / 6