よむ、つかう、まなぶ。
参考資料3:体外診断用医薬品の製造販売承認申請について(平成28年2月22日付け薬生発0222第5号厚生労働省医薬・生活衛生局長通知) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29413.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第8回 11/28)《厚生労働省》 |
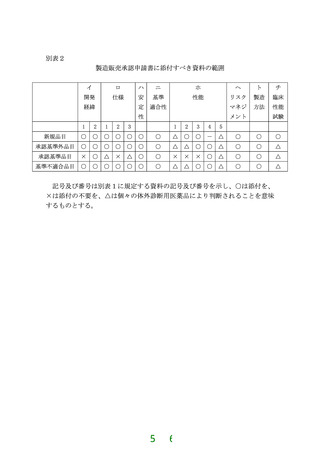
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和4年11月28日
医療機器・体外診断薬部会
参考資料3
薬 生発 0222 第 5号
平成 28 年2月 22 日
各都道府県知事
殿
厚生労働省医薬・生活衛生局長
(
公
印
省
略
)
体外診断用医薬品の製造販売承認申請について
体外診断用医薬品の製造販売承認申請の取扱いについては、
「体外診断用医薬
品の製造販売承認申請について」(平成 26 年 11 月 21 日付け薬食発 1121 第 15
号厚生労働省医薬食品局長通知。以下「旧局長通知」という。)等により実施し
てきたところです。
今般、「体外診断用医薬品の一般用検査薬への転用について」(平成 26 年 12
月 25 日付け薬食発 1225 第1号厚生労働省医薬食品局長通知)にしたがって策
定されたガイドラインに基づく一般用検査薬の承認申請の区分を明らかにする
ため、体外診断用医薬品の製造販売承認申請については下記のとおり取り扱う
こととしましたので、御了知の上、貴管内関係事業者宛て周知方御配慮願いま
す。
本通知は、本日から適用し、旧通知は本通知の適用に伴い廃止します。
記
第1
1
総則
体外診断用医薬品の製造販売の承認については、改正法による改正後の
「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」
(昭
和 35 年法律第 145 号。以下「法」という。)第 23 条の2の5及び法第 23
条の2の 17 第1項の規定に基づき、これを製造販売しようとする者又は選
任製造販売業者に製造販売させようとする者から申請があった場合に、法
第 23 条の2の5第1項に規定する厚生労働大臣が基準を定めて指定する体
外診断用医薬品及び法第 23 条の2の 23 第1項の規定に基づき厚生労働大
1 / 6
医療機器・体外診断薬部会
参考資料3
薬 生発 0222 第 5号
平成 28 年2月 22 日
各都道府県知事
殿
厚生労働省医薬・生活衛生局長
(
公
印
省
略
)
体外診断用医薬品の製造販売承認申請について
体外診断用医薬品の製造販売承認申請の取扱いについては、
「体外診断用医薬
品の製造販売承認申請について」(平成 26 年 11 月 21 日付け薬食発 1121 第 15
号厚生労働省医薬食品局長通知。以下「旧局長通知」という。)等により実施し
てきたところです。
今般、「体外診断用医薬品の一般用検査薬への転用について」(平成 26 年 12
月 25 日付け薬食発 1225 第1号厚生労働省医薬食品局長通知)にしたがって策
定されたガイドラインに基づく一般用検査薬の承認申請の区分を明らかにする
ため、体外診断用医薬品の製造販売承認申請については下記のとおり取り扱う
こととしましたので、御了知の上、貴管内関係事業者宛て周知方御配慮願いま
す。
本通知は、本日から適用し、旧通知は本通知の適用に伴い廃止します。
記
第1
1
総則
体外診断用医薬品の製造販売の承認については、改正法による改正後の
「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」
(昭
和 35 年法律第 145 号。以下「法」という。)第 23 条の2の5及び法第 23
条の2の 17 第1項の規定に基づき、これを製造販売しようとする者又は選
任製造販売業者に製造販売させようとする者から申請があった場合に、法
第 23 条の2の5第1項に規定する厚生労働大臣が基準を定めて指定する体
外診断用医薬品及び法第 23 条の2の 23 第1項の規定に基づき厚生労働大
1 / 6